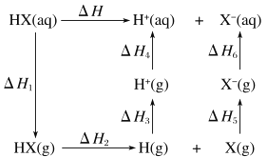
题目内容
【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大

【答案】分液漏斗 先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好 2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10CO2↑+8H2O 浓度 1×10-4mol/(L·s) 调节量气管高度使两液面相平 收集相同体积气体所需要的时间或KMnO4溶液完全褪色所需时间 AB
【解析】
(1)盛放A溶液的仪器是分液漏斗,如果气密性良好,关闭分液漏斗的活塞,再轻轻向外拉![]() 或向内压
或向内压![]() 注射器的活塞,松手后会恢复原位;
注射器的活塞,松手后会恢复原位;
(2)高锰酸钾作氧化剂被还原成MnO2,草酸作还原剂被氧化成二氧化碳,结合原子守恒进行分析;
(3)从表格看出,两组实验,草酸的浓度不一样;
(4)根据连通器原理,适当放低量气管;
(5)高锰酸钾有颜色,产物无色,可以从褪色时间角度分析;
(6)可用热量变化角度分析。
![]() 图1装置中盛放A溶液的仪器名称是分液漏斗,检查装置气密性的方法是先关闭分液漏斗的活塞,再轻轻向外拉
图1装置中盛放A溶液的仪器名称是分液漏斗,检查装置气密性的方法是先关闭分液漏斗的活塞,再轻轻向外拉![]() 或向内压
或向内压![]() 注射器的活塞,松手后恢复原位,表明气密性良好,故答案为:分液漏斗;先关闭分液漏斗的活塞,再轻轻向外拉
注射器的活塞,松手后恢复原位,表明气密性良好,故答案为:分液漏斗;先关闭分液漏斗的活塞,再轻轻向外拉![]() 或向内压
或向内压![]() 注射器的活塞,松手后恢复原位,表明气密性良好
注射器的活塞,松手后恢复原位,表明气密性良好 ![]() 合理即可
合理即可![]() ;
;
![]() 和
和![]() 发生氧化还原反应生成锰离子、二氧化碳、水,
发生氧化还原反应生成锰离子、二氧化碳、水,![]() 中锰降低了5价,1个
中锰降低了5价,1个![]() 分子中有2个
分子中有2个![]() 价的C,所以升高
价的C,所以升高![]() 价,根据化合价升降总数相等可以确定
价,根据化合价升降总数相等可以确定![]() 和
和![]() 比例关系为2:5,根据电荷守恒配平方程式:
比例关系为2:5,根据电荷守恒配平方程式:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 对比
对比![]() 实验可探究浓度对化学反应速率的影响,
实验可探究浓度对化学反应速率的影响,![]() 中A溶液的浓度比
中A溶液的浓度比![]() 中大,
中大,![]() 的物质的量是:
的物质的量是:![]() ,设40s末参加反应的
,设40s末参加反应的![]() 的物质的量为x,
的物质的量为x,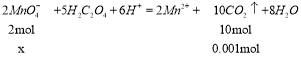 ,解得
,解得 ![]() ,则
,则 ![]() 浓度的改变量为:
浓度的改变量为:![]() ,
,![]()
![]() ,故答案为:浓度;
,故答案为:浓度;![]() ;
;![]() 通过测定
通过测定![]() 溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,应该调节量气管高度使两液面相平,故答案为:调节量气管高度使两液面相平;
溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,应该调节量气管高度使两液面相平,故答案为:调节量气管高度使两液面相平;
![]() 除了通过测定单位时间内生成
除了通过测定单位时间内生成![]() 的体积来比较反应速率,本实验还可以通过测定收集相同体积气体所需要的时间或
的体积来比较反应速率,本实验还可以通过测定收集相同体积气体所需要的时间或 ![]() 溶液完全褪色所需时间来比较化学反应速率,故答案为收集相同体积气体所需要的时间或KMnO4溶液完全褪色所需时间;
溶液完全褪色所需时间来比较化学反应速率,故答案为收集相同体积气体所需要的时间或KMnO4溶液完全褪色所需时间;
![]() 升高温度会加快反应的速率,催化剂也能加快化学反应的速率,产物
升高温度会加快反应的速率,催化剂也能加快化学反应的速率,产物![]() 或
或![]() 是反应的催化剂,故答案为:AB。
是反应的催化剂,故答案为:AB。