题目内容
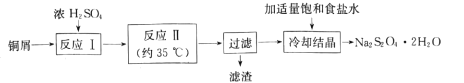
【题目】某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
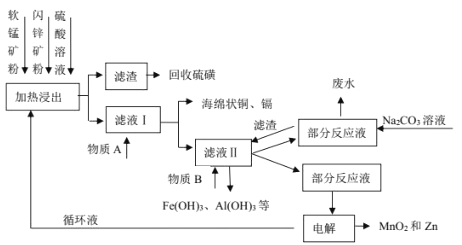
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________

【答案】3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O CaSO3 CaCO3 或(和)CaSO4 Zn MnO2 防止带入 Na+等杂质 纯锌(或 Zn) Mn2++2H2O-2e-=MnO2+4H+ 10.3 HCO3->CO32->H2CO3(或CO2) 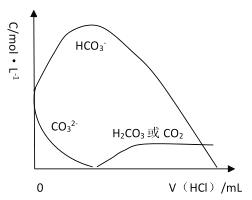
【解析】
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)硫发生歧化反应,生成低价硫化物如CaS等和高价硫的含氧酸盐如CaSO3、及其氧化产物CaSO4等;
(3)滤液1中加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd;物质B中MnO2,其作用是将Fe2+氧化为Fe3+;
(4)再加入Zn(OH)2等再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,另外物质可以是Zn(OH)2、Mn(OH)2、ZnCO3、MnCO3等难溶固体;故不用Na2CO3 的原因是防止带入 Na+等杂质;
(5)阳极Mn2+失电子发生氧化反应,生成MnO2;
(6)0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-,据此可以判定混合液中离子浓度大小关系;Na2CO3 和 NaHCO3 的混合溶液显碱性,以碳酸钠水解为主,根据水解平衡常数、碳酸的Ka2可以计算出c(OH-),进而求出c(H+),从而求出pH;Na2CO3 和 NaHCO3 的混合溶液不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,据此画图。
(1)MnO2在酸性溶液与FeS反应生成硫酸铁、硫酸锰、S与水,生成硫磺的反应方程式3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O。
故答案为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O;
(2)在反应器内加水使石灰溶解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,生成低价硫化物如CaS等和高价硫的含氧酸盐如CaSO3、及其氧化产物CaSO4等,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是CaSO3 ,残留的固体杂质可能是 CaCO3 或(和)CaSO4。
故答案为:CaSO3 ; CaCO3 或(和)CaSO4;
(3)滤液1中加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd;物质B中MnO2,其作用是将Fe2+氧化为Fe3+;物质 A 和 B的化学式 Zn、MnO2。
故答案为: Zn;MnO2;
(4)再加入Zn(OH)2等再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,不在滤液Ⅱ中直接加入 Na2CO3 的原因是防止带入 Na+等杂质。
故答案为:防止带入 Na+等杂质;
(5)电解时的阴极材料为纯锌(或 Zn),阳极Mn2+失电子发生氧化反应,生成MnO2,阳极的电极反应式为:Mn2++2H2O-2e-=MnO2+4H+。
故答案为:纯锌(或 Zn);Mn2++2H2O-2e-=MnO2+4H+ ;
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,得的水解常数为:![]() ,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中c(HCO3-)=c(CO32-),即c(OH-)=
,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中c(HCO3-)=c(CO32-),即c(OH-)=![]() =2×10-4,pH=-lg5×10-11=10+lg2=10.3;0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-电离,溶液中含碳微粒的浓度从大到小的顺序为;HCO3->CO32->H2CO3(或CO2);向此溶液中不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,H2CO3在CO32-+H+=HCO3-后逐渐增大 ,其含碳微粒浓度变化的曲线。
=2×10-4,pH=-lg5×10-11=10+lg2=10.3;0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-电离,溶液中含碳微粒的浓度从大到小的顺序为;HCO3->CO32->H2CO3(或CO2);向此溶液中不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,H2CO3在CO32-+H+=HCO3-后逐渐增大 ,其含碳微粒浓度变化的曲线。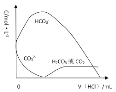 ;
;
故答案为:10.3;HCO3->CO32->H2CO3(或CO2);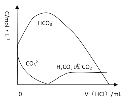

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案