题目内容
【题目】下列离子方程式书写正确的是
A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
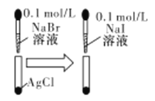
B.K2S 溶液中加入AgCl 固体反应的离子方程式为:2AgCl+S2-===2Cl-+Ag2S
C.苯酚钠溶液中通入少量二氧化碳: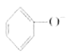 +CO2+H2O→
+CO2+H2O→![]() +CO32-
+CO32-
D.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
【答案】B
【解析】
A.Fe(OH)3 溶于氢碘酸时,因为Fe3+具有氧化性,I-有还原性,所以二者还要发生氧化还原反应生成亚铁离子和碘离子,故A错误;
B.K2S 溶液中加入AgCl 固体,因为在相同条件下硫化银的溶解度小于氯化银的溶解度,所以氯化银可以转化成硫化银,故B正确;
C.因为酸性:碳酸>苯酚>碳酸氢根,所以苯酚钠溶液中通入少量二氧化碳时,只能生成碳酸氢钠,不能生成碳酸钠,故C错误;
D.因为氯气的氧化性强于铁离子和溴单质,所以过量的氯气可以将亚铁离子和溴离子全部氧化,而溴化亚铁中,亚铁离子与溴离子的比例关系为1:2,所以反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D错误;
综上所述,答案为B。

【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D