题目内容
8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )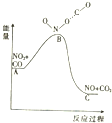
| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
分析 A、由图象可知,该反应是一个能量降低的反应,即放热反应;
B、根据反应前后有无化合价变化判断;
C、根据放热反应反应物的键能总和小于生成物的键能总和;
D、根据放热反应反应物的总能量大于生成物的总能量.
解答 解:A、由图象可知,该反应是一个能量降低的反应,即放热反应,故A正确;
B、反应前后化合价发生变化,则为氧化还原反应,故B错误;
C、由A知该反应为放热反应,则放热反应反应物的键能总和小于生成物的键能总和,故C错误;
D、由A知该反应为放热反应,放热反应反应物的总能量大于生成物的总能量,故D错误.
故选A.
点评 本题考查了放热反应的判断、氧化还原反应以及放热反应的原因的分析等,难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
18.N0为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 mol Cl2作为氧化剂得到的电子数为N0 | |
| B. | 1.0 mol•L-1 NaAlO2溶液中含有Na+数目为N0 | |
| C. | 1 mol的甲基与1 mol的羟基所含电子数均为9N0 | |
| D. | 92 g NO2、N2O4混合气体含有的分子数为2N0 |
16.下列有关化学用语表示正确的是( )
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: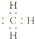 | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
3.如图装置的电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
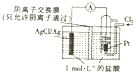

| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
13.矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金-氰化法提炼,及采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸取如溶液中,然后用金属锌作还原剂将金从溶液中置换析出,其反应原理为:
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
20.根据如表实验操作及现象,能得到相应结论的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将pH为11的氨水稀释10倍,测量所得pH大于10 | 加水稀释NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 水解程度:CO32->HCO3- |
| C | 镁粉加入NH4Cl溶液中,有刺激性气味气体放出 | 该气体含有NH3 |
| D | 某气体能使酸性KMnO4溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
17.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到平衡的标志是( )
| A. | 单位时间内生成n mol X,同时消耗3n molY | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的物质的量分数均保持不变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |