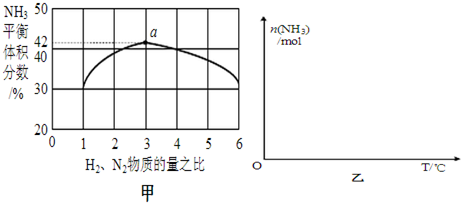
题目内容
16.下列有关化学用语表示正确的是( )| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: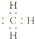 | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
分析 A.比例模型反应原子的大小,碳原子的相对体积大于氢原子;
B.甲基为电中性基团,碳原子有1个单电子,碳原子最外层为7个电子;
C.乙醇为含有2个碳原子的饱和一元醇;
D.质量数=质子数+中子数,元素符号的左上角表示质量数,左下角表示质子数.
解答 解:A.乙烯的碳原子半径大于氢原子,则乙烯正确的比例模型为: ,故A错误;
,故A错误;
B.甲烷去掉1个H原子剩余部分为甲基,甲基为电中性基团,碳原子有1个单电子,正确的电子式为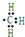 ,故B错误;
,故B错误;
C.乙醇分子中含有1个甲基、1个亚甲基和1个羟基,乙醇的分子式为:C2H6O,故C正确;
D.中子数为53、质子数为78的碘原子的质量数为131,该原子的正确表示方法为:78131I,故D错误;
故选C.
点评 本题考查化学用语的表示方法判断,题目难度中等,涉及分子式、比例模型与球棍模型、电子式、元素符号等知识,注意常见化学用语的书写原则,明确甲基与甲烷、羟基与氢氧根离子的区别,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.有机化合物M是中药狼把草的成分之一,它具有消炎杀菌作用,M的结构如图所示,下列叙述正确的是( )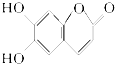

| A. | M的摩尔质量是180g/mol | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 mol M与足量NaHCO3反应能生成4 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
7.Ⅰ.根据等电子体原理可知:
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.

如图中的M是短周期金属元素,M的部分电离能如表:
(4)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
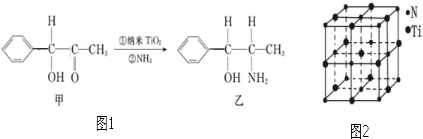
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.

如图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |

4.以下叙述正确的是( )
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
1.向淀粉溶液中加少量稀H2SO4,加热,使淀粉水解,为测定其是否完全水解,需要加入的试剂是( )
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )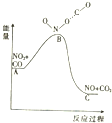

| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
5.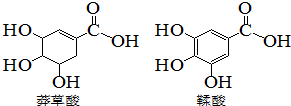 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
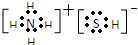 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.