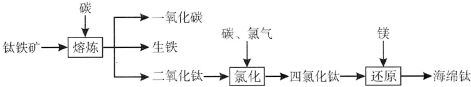
题目内容
13.矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金-氰化法提炼,及采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸取如溶液中,然后用金属锌作还原剂将金从溶液中置换析出,其反应原理为:①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
分析 A.依据题干:金属锌作还原剂将金从溶液中置换析出判断;
B.依据化合物中各元素化合价代数和为0解答;
C.依据反应4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH判断解答;
D.在提炼过程中含金元素的物质中金元素的化合价先升高后降低.
解答 解:A.金属锌作还原剂将金从溶液中置换析出,说明Na[Au(CN)2]可溶于水,故A正确;
B.化合物Na[Au(CN)2]中钠的化合价为+1价,氰根离子的化合价为-1价,则金元素的化合价为+1,故B错误;
C.依据方程式:4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH,可知金能够与氰化钠、氧气和水反应,故错误;
D.在提炼过程中含金元素的物质中金元素的化合价先升高后降低,即先作还原剂,后作氧化剂,故D错误;
故选:A.
点评 本题考查了金属的冶炼,明确金属的性质是解题关键,注意把握题干给出信息,题目难度不大.

练习册系列答案
相关题目
4.以下叙述正确的是( )
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
1.向淀粉溶液中加少量稀H2SO4,加热,使淀粉水解,为测定其是否完全水解,需要加入的试剂是( )
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )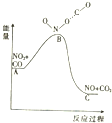

| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
18.肉桂醛是GB2076-2011规定允许使用的食品香料,其结构简式如图.下列说法不正确的是( )

| A. | 1mol该物质最多可与2molH2发生加成反应 | |
| B. | 该物质的分子式为C9H8O | |
| C. | 加热时,该物质能与新制Cu(OH)2悬浊液反应 | |
| D. | 该物质既能发生加成反应,也能发生取代反应 |
5.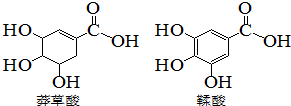 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
3.将0.390g锌粉加入到20.0mL 0.200mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |