题目内容
18.化学与生活联系紧密,下列说法正确的是( )| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
分析 A.防腐剂主要作用是抑制微生物的生长和繁殖,以延长食品的保存时间,生石灰和水反应生成氢氧化钙,食品包装袋中常用生石灰做食品的干燥剂;
B.豆腐为胶体豆浆聚沉后的物质,其中含有较多的钙盐(如硫酸钙CaSO4等);
C.金属钠为活泼金属,着火时,可与二氧化碳、水反应;
D.84”消毒液,其主要成分是NaClO,NaClO能与水、二氧化碳生成次氯酸,次氯酸具有强氧化性,能使蛋白质发生变性.
解答 解:A.食品包装袋中常用苯甲酸等防腐剂,生石灰为干燥剂,故A错误;
B.豆浆是胶体,胶体遇电解质发生聚沉,硫酸钙溶液能使豆浆凝结为豆腐,故B错误;
C.碳酸氢钠干粉灭火器灭火发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成的二氧化碳、水和过氧化钠反应生成氧气助燃,所以不能用碳酸氢钠干粉灭火器灭火,故C错误;
D.84”消毒液,其主要成分是NaClO,NaClO能与水、二氧化碳生成次氯酸,次氯酸具有强氧化性,能使蛋白质变性,可杀死流感病毒,故D正确;
故选D.
点评 本题主要考查了化学与生活联系知识,掌握生石灰、胶体性质、钠的化学性质、以及蛋白质的变性等知识是解答的关键,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )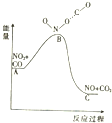

| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
3.将0.390g锌粉加入到20.0mL 0.200mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
7.化学与生产生活、环境保护、资源利用密切相关.下列做法不正确的是( )
| A. | 用工业废水直接灌溉农田 | B. | 用可降解塑料做购物袋 | ||
| C. | 将煤气化或液化获得清洁燃料 | D. | 火力发电厂的燃煤中加适量石灰石 |
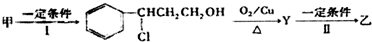
 +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$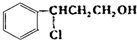 ,反应II的反应类型为消去反应.
,反应II的反应类型为消去反应. .
.