题目内容
17.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到平衡的标志是( )| A. | 单位时间内生成n mol X,同时消耗3n molY | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的物质的量分数均保持不变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.单位时间内生成3nmolX同时消耗nmolY时,该反应达到平衡状态,当单位时间内生成n mol X、同时消耗3n molY时该反应没有达到平衡状态,故A错误;
B.X的生成速率与Z的生成速率之比为3:2时该反应达到平衡状态,当X的生成速率等于Z的生成速率时该反应没有达到平衡状态,故B错误;
C.X、Y、Z的物质的量分数均保持不变,说明正逆反应速率相等,该反应达到平衡状态,故C正确;
D.X、Y、Z的分子个数比为3:1:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始物质的量及转化率有关,故D错误;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,易错选项是D.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
7.Ⅰ.根据等电子体原理可知:
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.
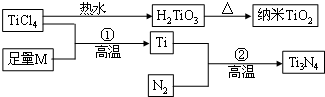
如图中的M是短周期金属元素,M的部分电离能如表:
(4)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
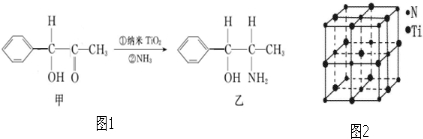
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.

如图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |

8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )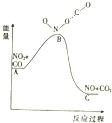

| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
5.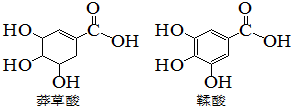 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
12.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
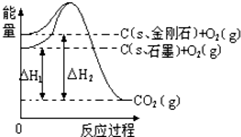

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
7.化学与生产生活、环境保护、资源利用密切相关.下列做法不正确的是( )
| A. | 用工业废水直接灌溉农田 | B. | 用可降解塑料做购物袋 | ||
| C. | 将煤气化或液化获得清洁燃料 | D. | 火力发电厂的燃煤中加适量石灰石 |