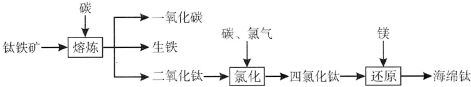
题目内容
18.N0为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1 mol Cl2作为氧化剂得到的电子数为N0 | |
| B. | 1.0 mol•L-1 NaAlO2溶液中含有Na+数目为N0 | |
| C. | 1 mol的甲基与1 mol的羟基所含电子数均为9N0 | |
| D. | 92 g NO2、N2O4混合气体含有的分子数为2N0 |
分析 A.1mol氯气与金属单质反应生成2mol氯离子,得到了2mol电子;
B.缺少溶液体积,无法计算溶液中钠离子数目;
C.1mol甲基和1mol羟基都含有9mol电子;
D.二氧化氮和四氧化二氮的摩尔质量不同,则等质量的二者含有的分子数不相等.
解答 解:A.1 mol Cl2作为氧化剂,若与金属反应会生成2mol氯离子,得到了2mol电子,得到的电子数为2N0,故A错误;
B.没有告诉溶液体积,无法计算溶液中钠离子的数目,故B错误;
C.1 mol的甲基中含有9mol电子,1 mol的羟基中含有9mol电子,二者所含电子数均为9N0,故C正确;
D.二氧化氮的摩尔质量为46g/mol,四氧化二氮的摩尔质量为92g/mol,二者的摩尔质量不同,则等质量的二者的物质的量不相等,含有的分子数不相等,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明B为易错点,注意题中缺少溶液体积,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
9.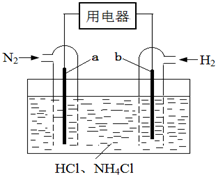 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
6.有机化合物M是中药狼把草的成分之一,它具有消炎杀菌作用,M的结构如图所示,下列叙述正确的是( )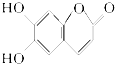

| A. | M的摩尔质量是180g/mol | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 mol M与足量NaHCO3反应能生成4 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
10.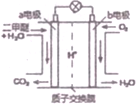 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| D. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ |
7.Ⅰ.根据等电子体原理可知:
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.

如图中的M是短周期金属元素,M的部分电离能如表:
(4)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
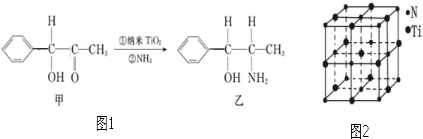
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.

如图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |

8.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )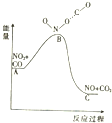

| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |

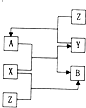 X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)
X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)