题目内容
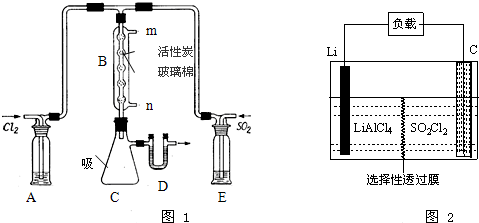
19.如图(1)表示一些晶体中的某些结构,它们分别是NaCl、干冰、CsCl、金刚石、石墨结构中的某一种的某一部分(1)上述五种物质熔点由高到低的排列顺序为EDACB(用字母代号表示)
(2)CsCl晶体中离子的配位数是8,NaCl与CsCl是两种不同类型的晶体结构,其主要原因是阳离子半径不同
(3)干冰中每个CO2分子与12个CO2分子紧邻,石墨中每个正六边形占有的碳原子数平均为2个
(4)假设干冰中CO2分子与CO2分子之间最近的距离为acm,阿伏伽德罗常数用NA表示,则干冰的密度为$\frac{44\sqrt{2}}{{a}^{3}{N}_{A}}$g/cm3
(5)已知FeS2晶体具有如图(2)空间结构,则FeS2晶体中具有的化学键类型是离子键和非极性键,铁原子的价电子排布式是3d64s2
分析 (1)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比;
(2)根据CsCl结构结构知,CsCl晶胞中离子配位数是8,NaCl、CsCl晶胞结构受离子半径大小影响;
(3)干冰中每个CO2分子与其紧邻的CO2分子个数=3×8÷2,石墨中每个C原子被3个六边形共用,每个正六边形占有的碳原子数平均个数=$\frac{1}{3}×6$;
(4)干冰晶胞中二氧化碳分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,假设干冰中CO2分子与CO2分子之间最近的距离为acm,其距离为面对角线的$\frac{1}{2}$,所以其体对角线长度为2acm,晶胞边长=$\sqrt{2}$acm,其体积V=($\sqrt{2}$acm)3,干冰的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;
(5)该晶胞中白色球个数=黑色球个数=4×$\frac{1}{8}$=$\frac{1}{2}$,所以黑色球和白色球个数之比为1:1,FeS2晶体中存在Fe2+和S22-离子,阴阳离子之间存在离子键,同种非金属元素原子之间存在非极性键;Fe是26号元素,其原子核外有26个电子,其3d、4s能级上电子为其价电子.
解答 解:(1)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比,金刚石是原子晶体、NaCl和CsCl是离子晶体、干冰是分子晶体、石墨是混合型晶体,根据配位数及晶胞结构知,A、B、C、D、E分别是NaCl、干冰、CsCl、金刚石、石墨,钠离子半径小于铯离子半径,石墨中C-C键长小于金刚石中C-C键长,所以这几种晶体熔点高低顺序是EDACB,
故答案为:EDACB;
(2)根据CsCl结构结构知,CsCl晶胞中离子配位数是8,NaCl、CsCl晶胞结构受离子半径大小影响,铯离子半径大于钠离子半径,所以二者晶胞结构不同,故答案为:8;晶体中阳离子半径不同;
(3)干冰中每个CO2分子与其紧邻的CO2分子个数=3×8÷2=12,石墨中每个C原子被3个六边形共用,每个正六边形占有的碳原子数平均个数=$\frac{1}{3}×6$=2,
故答案为:12;2;
(4)干冰晶胞中二氧化碳分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,假设干冰中CO2分子与CO2分子之间最近的距离为acm,其距离为面对角线的$\frac{1}{2}$,所以其体对角线长度为2acm,晶胞边长=$\sqrt{2}$acm,其体积V=($\sqrt{2}$acm)3,干冰的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{44}{{N}_{A}}×4}{(\sqrt{2}a)^{3}}$g/cm3=$\frac{44\sqrt{2}}{{a}^{3}{N}_{A}}$g/cm3,故答案为:$\frac{44\sqrt{2}}{{a}^{3}{N}_{A}}$;
(5)该晶胞中白色球个数=黑色球个数=4×$\frac{1}{8}$=$\frac{1}{2}$,所以黑色球和白色球个数之比为1:1,FeS2晶体中存在Fe2+和S22-离子,阴阳离子之间存在离子键,同种非金属元素原子之间存在非极性键,所以该晶胞中存在离子键和非极性键;Fe是26号元素,其原子核外有26个电子,其3d、4s能级上电子为其价电子,Fe原子价电子排布式为3d64s2,
故答案为:离子键和非极性键;3d64s2.
点评 本题考查晶胞计算及原子核外电子排布式的书写,为高频考点,侧重考查学生计算及空间想象能力,注意:干冰晶胞中距离最近的两个二氧化碳分子分别位于面心和顶点上,注意石墨熔点高于金刚石,但二者沸点相同,为易错点.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案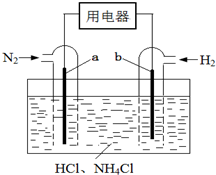 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
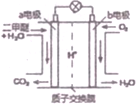 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| D. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ |
(1)仅由第二周期元素组成的共价分子中互为等电子体的有2组
(2)在短周期元素组成的物质中,与NO2?互为等电子体的分子有2种
(3)试预测N3-的空间构型为直线形.
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图)可以制得Ti3N4和纳米TiO2.
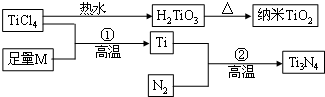
如图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(5)基态Ti3+中未成对电子数有1个,与Ti同族相邻的元素Zr的基态原子外围电子排布式为4d25s2;钛元素最高化合价为+4.
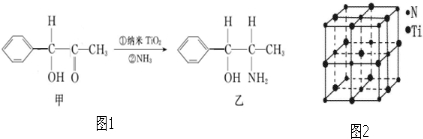
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示.
化合物甲的分子中采取sp2方式杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
| A. | 反应起始时,两容器中生成N2O4的速率关系是v(A)=v(B) | |
| B. | 反应达到平衡前,两容器中生成N2O4的速率关系是v(A)<v(B) | |
| C. | 反应达到平衡后,NO2的转化率大小关系是v(A)<v(B) | |
| D. | 两容器均达到平衡后,再分别充入等量的氮气,发生平衡移动的是B容器,且平衡移动后,NO2的转化率将增大 |
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
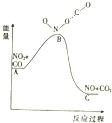
| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
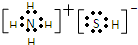 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.