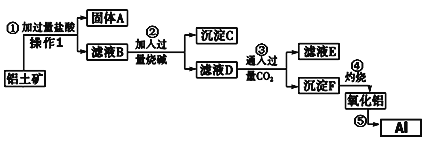
题目内容
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:

Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
【答案】3d24s2 d ABC sp2 < N原子上有一对孤对电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力 Na>O>N 6 ![]() ×107
×107
![]()
【解析】
(1) Ti是22号元素,根据原子构造原理可得其核外电子排布式,得到基态Ti原子的价电子排布式,并根据元素原子结构与元素在周期表的位置关系判断其所属区域;
(2)KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P=O键、O-H键,可形成氢键;
(3)根据N、O原子间形成的电子对分析原子杂化,并结合孤电子对与成键电子对之间的作用力情况判断键角大小;
(4)从元素的+1价离子的稳定性大小分析I2大小;
(5)根据晶胞在各种微粒的空间构型及相对位置判断Ti的配位体数目;用均摊法计算一个晶胞中含有的各种元素的原子个数,计算晶胞的质量,利用m=ρV、及边长V= L3计算晶胞边长,最后根据Ba与O原子的位置在面对角线的一半就可计算出两个微粒间的距离。
(1)Ti的原子序数为22,则基态原子的价电子排布式为3d24s2,位于第四周期IVB族,属于d区,故答案为3d24s2;d;
(2) KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P=O键、2个O-H键,故可可形成氢键,故合理选项是ABC;
(3)NO2-的中心原子的价层电子对数为3,所以NO2-中的N原子采用sp2杂化,N原子的3个杂化轨道,其中一个被孤电子对占有,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力,所以键角小于120°,故答案为sp2;<;N原子上有一对孤对电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力;
(4) 由于Na+是最外层8个电子的稳定结构,气态基态Na+从8电子稳定结构再失去一个电子最难,气态基态O+从2p3半充满较稳定结构再失去一个电子较难。所以Na+ 的第二电离能I2最大,N+最小,因此三种元素的第二电离能(I2)由大到小的顺序为Na>O>N;
(5)根据晶胞结构示意图可知:Ti位于晶胞中心,O原子位于晶胞六个面心上,Ba位于晶体的8个顶点上,所以Ti的配位体数目是6;在一个晶胞中含有的各种元素的原子个数Ti:1×1=1;Ba:![]() ×8=1,O:
×8=1,O:![]() ×6=3,即一个晶胞中含有1个BaTiO3,其质量m=
×6=3,即一个晶胞中含有1个BaTiO3,其质量m=![]() g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=
g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=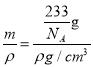 =
=![]() cm3,则晶胞的边长L=
cm3,则晶胞的边长L=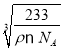 cm=
cm=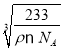 ×107nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=
×107nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=![]() L=
L=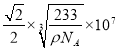 nm,故答案为6;
nm,故答案为6;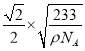 ×107。
×107。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案