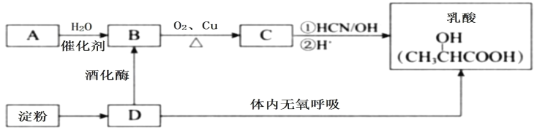
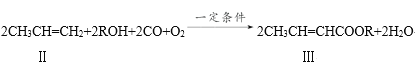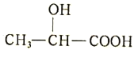题目内容
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A.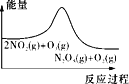 平衡后升温,NO2含量降低
平衡后升温,NO2含量降低
B.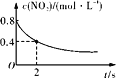 0~2 s内,v(O3)=0.2 mol·L-1·s-1
0~2 s内,v(O3)=0.2 mol·L-1·s-1
C.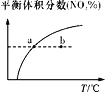 v正:b点>a点,b点:v逆 > v正
v正:b点>a点,b点:v逆 > v正
D.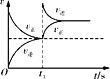 恒温,t1时再充入O3
恒温,t1时再充入O3
【答案】C
【解析】
A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度,平衡向逆反应方向移动,NO2的含量增大,故A错误;
B.由图可知,0-2s内,二氧化氮的浓度变化量=0.8molL-1-0.4molL-1=0.4molL-1,故v(NO2)=![]() =0.2molL-1s-1,v(O3)=
=0.2molL-1s-1,v(O3)=![]() v(NO2)=0.1molL-1s-1,故B错误;
v(NO2)=0.1molL-1s-1,故B错误;
C.温度高,化学反应速率快,b点温度高于a点,故V正:b点>a点;b点的NO2的分数未达到平衡的分数,则平衡向生成NO2的方向移动,即平衡向逆反应方向移动,故b点:v逆>v正,故C正确;
D.容器中充入反应物,正反应速率瞬间加快,逆反应速率不变,然后平衡移动至建立新平衡,该效果与图示不符,故D错误;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
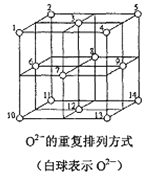
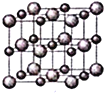
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:可能用到的有关数据如下:

相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是___;a的名称是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为___。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(3)用碳酸钠溶液洗涤的作用是___,操作X的名称为___。
Ⅲ.产物分析及产率计算:
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有__种不同化学环境的氢原子。②本实验所得环己烯的产率是___。