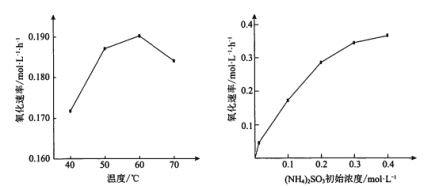
题目内容
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述正确的是
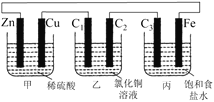
A.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
B.C3是阴极,锌片、C2上都发生氧化反应
C.甲中H+向铜电极移动,丙中Cl-向铁电极移动
D.甲中硫酸溶液的浓度逐渐变小,丙中溶液的pH逐渐减小
【答案】A
【解析】
甲池中Zn、Cu和稀硫酸组成原电池,Zn电极为电源负极,Cu电极为电源正极;乙池和丙池为电解池,C1为乙池阳极,C2为乙池阴极,Fe为丙池阴极,C3为丙池阳极,据此分析。
A.根据分析,C1在乙池中做阳极,氯化铜中Cl-在此电极上失电子生成氯气,C3在丙池中做阳极,氯化钠中Cl-在此电极上失电子生成氯气;铜片在甲池做正极,溶液中的H+得到电子生成氢气,铁片在丙池做阴极,溶液中水电离出的H+在此电极上得到电子也生成氢气,A正确;
B.根据分析,C3为电解池的阳极,Zn电极失去电子发生氧化反应,C2电极得到电子发生还原反应,B错误;
C.甲池中H+向Cu电极移动得电子生成氢气,丙池中Cl-向C3电极移动失电子生成氯气,C错误;
D.甲池中H+得电子生成氢气,Zn失电子生成Zn2+,溶液中硫酸浓度不断减小硫酸锌浓度不断增大;丙池中Cl-失电子生成氯气,H+得电子生成氢气,溶液中剩余NaOH,溶液pH变大,D错误;
故选A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:可能用到的有关数据如下:

相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是___;a的名称是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为___。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(3)用碳酸钠溶液洗涤的作用是___,操作X的名称为___。
Ⅲ.产物分析及产率计算:
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有__种不同化学环境的氢原子。②本实验所得环己烯的产率是___。