题目内容
【题目】某温度下,![]() 。向物质的量浓度相同的
。向物质的量浓度相同的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液产生
溶液产生![]() 、
、![]() 两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
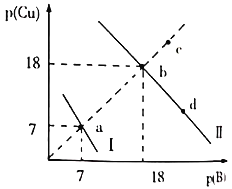
图中的![]() ,
,![]() 或
或![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.曲线Ⅰ表示的是Cu2+与OH-浓度关系的曲线
B.该温度下,![]()
C.升高温度时,b点会向c点移动
D.向d点对应的溶液中加入对应阴离子的钠盐固体,d点向b点移动
【答案】C
【解析】
A.若曲线I表示的是Cu2+与OH-浓度关系,则c(OH-)=c(Cu2+)=1.0![]() 10-7mol/L,c2(OH-)
10-7mol/L,c2(OH-)![]() c(Cu2+)=(1.0
c(Cu2+)=(1.0![]() 10-7mol/L)2
10-7mol/L)2![]() 1.0
1.0![]() 10-7mol/L=1.0
10-7mol/L=1.0![]() 10-21=
10-21=![]() ,故A正确;
,故A正确;
B.根据A选项分析,曲线II表示CuS的溶解平衡曲线,当达到平衡时,c(S2-)=c(Cu2+)=1.0![]() 10-18mol/L
10-18mol/L![]() 1.0
1.0![]() 10-18 mol/L=1.0
10-18 mol/L=1.0![]() 10-36, 所以该温度下,
10-36, 所以该温度下,![]() ,故B正确;
,故B正确;
C.升高温度时,沉淀的溶解平衡向正向移动,c(S2-)、c(Cu2+)都会增大,故C错误;
D.该温度下,向d点对应的溶液中加入硫化钠,硫离子的浓度增大,沉淀的溶解平衡向逆向移动(形成沉淀的方向),c(Cu2+)会减小,d点向b点移动,故D正确;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
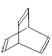
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
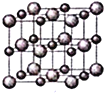
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。