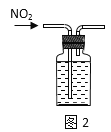
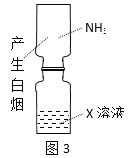
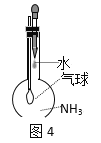
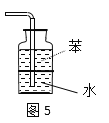
题目内容
【题目】从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下:
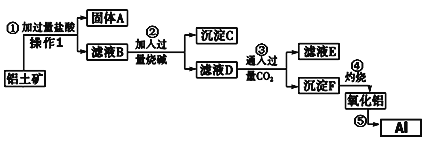
则回答下列问题:
(1)操作1的名称为____________,用到的玻璃仪器除玻璃棒、烧杯外,还需_________;
(2)沉淀C的成分为________________(写化学式);
(3)设计最简实验证明滤液D中Fe3+已沉淀完全(写出操作、现象及结论,试剂任选):取2mL滤液D于试管中,__________________________。
(4)滤液E中的主要溶质的化学式为________________;
(5)写出步骤⑤的化学方程式________________________。
【答案】过滤(洗涤、干燥) 漏斗 Fe(OH)3、Mg(OH)2 再向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全。(其它合理答案也可,如滴入NaOH无沉淀等) NaCl、NaHCO3 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据流程图,从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝,铝土矿用盐酸溶解后得到的固体为SiO2,滤液B中含有铝离子、铁离子和镁离子,以及过量的盐酸,滤液B中加入过量烧碱,得到的沉淀为氢氧化铁和氢氧化镁,滤液D中含有偏铝酸钠,偏铝酸钠中通入过量二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,氢氧化铝灼烧后再电解生成金属铝。
(1)根据上述分析操作1的名称为过滤,过滤用到的玻璃仪器除玻璃棒、烧杯外,还需漏斗,故答案为过滤(洗涤、干燥);漏斗;
(2)沉淀C的中含有氢氧化铁和氢氧化镁,故答案为Fe(OH)3、Mg(OH)2;
(3)证明滤液D中Fe3+已沉淀完全的操作方法为:取2mL滤液D于试管中,向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全,故答案为向其中加入2滴KSCN溶液,溶液无血红色出现,则证明Fe3+已沉淀完全;
(4)根据上述分析,滤液E中的主要溶质有氯化钠和碳酸氢钠,故答案为NaCl、NaHCO3;
(5)步骤⑤是电解熔融氧化铝制取铝的反应,化学方程式为:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。

【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8种元素中,第一电离能介于①元素和③元素间的元素有__种。
(2)表中能形成两性氢氧化物的元素是___(填元素名称![]() ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
(3)②、⑤、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)___。
(4)④元素与⑩元素两者质子数之差是___。
(5)请写出③的气体氢化物发生催化氧化的化学方程式___。
(6)请写出⑥元素的最高价氧化物的水化物与⑧元素的最高价氧化物的水化物反应的离子方程式___。