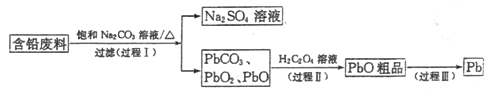
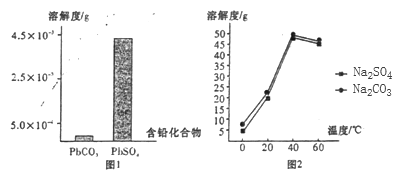
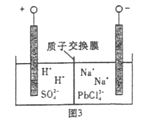
题目内容
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
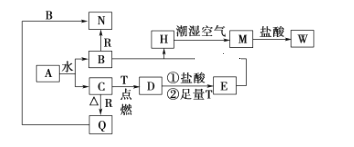
(1)写出下列物质的化学式A:_______________,Q:_____________,W:__________________。
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:_______________________
②R与B溶液反应时的离子方程式:___________________________________
③D与盐酸反应的离子方程式:_______________________________________
(3)简述检验气体C的方法:___________________________________________
【答案】Na2O2 Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe3O4+8H+= Fe3++2Fe2++4H2O 用带火星的木条伸入收集满该气体的集气瓶瓶口,若木条复燃,则气体是氧气
【解析】
H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,则H为氢氧化亚铁,金属T为Fe;氢氧化亚铁与潮湿的空气反应生成氢氧化铁,M为氢氧化铁;氢氧化铁与盐酸反应生成氯化铁,则W为氯化铁;A为淡黄色固体,则A为过氧化钠,B为氢氧化钠,C为氧气;D为四氧化三铁;可以和氢氧化钠反应的金属为Al;氧气与铝反应生成氧化铝,则Q为氧化铝、N为偏铝酸钠。
(1)分析可知,A为过氧化钠,化学式为Na2O2;Q为氧化铝,化学式为Al2O3;W为氯化铁,化学式为FeCl3;
(2) ①H(氢氧化亚铁)在潮湿空气中变成M(氢氧化铁)的过程中为氢氧化亚铁与氧气、水反应生成氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②R与B溶液反应为Al与NaOH反应生成偏铝酸钠和氢气,离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③D与盐酸反应为四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,离子方程式为Fe3O4+8H+= Fe3++2Fe2++4H2O;
(3)通常用带火星的木条靠近盛有该气体的集气瓶,若木条复燃,则为氧气。

【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8种元素中,第一电离能介于①元素和③元素间的元素有__种。
(2)表中能形成两性氢氧化物的元素是___(填元素名称![]() ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
(3)②、⑤、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)___。
(4)④元素与⑩元素两者质子数之差是___。
(5)请写出③的气体氢化物发生催化氧化的化学方程式___。
(6)请写出⑥元素的最高价氧化物的水化物与⑧元素的最高价氧化物的水化物反应的离子方程式___。
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变