题目内容
13.炭的化合物有着相当广泛的用途.请回答下列问题:(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
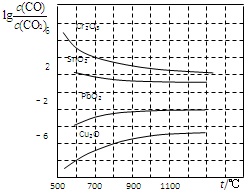
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.
分析 (1)①C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
将方程式①-②-③得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3;
(2)酸性燃料电池中,负极上燃料失电子生成二氧化碳和水;
(3)①参加反应的n(CO)=2mol-0.2mol/L×2L=1.6mol,转化率=$\frac{1.6mol}{2mol}×100%$;
②浓度商=$\frac{0.4}{0.1×0.{2}^{2}}$=100<160,平衡正向移动;
根据表中数据知,反应初始氢气浓度=0.2mol/L+0.4mol/L×2=1.0mol/L,
平衡时c(H2)=0.4mol•L-1,则参加反应的c(H2)=1mol/L-0.4mol•L-1=0.6mol/L,
则氢气的反应速率=$\frac{0.6mol/L}{10min}$=0.06mol/(L.min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算甲醇反应速率;
(4)相同温度下,lg[$\frac{c(CO)}{c(C{O}_{2})}$]越小,说明化学平衡常数越大,还原反应越容易;
根据图知,800℃时,lg[$\frac{c(CO)}{c(C{O}_{2})}$]=-6,则$\frac{c(C{O}_{2})}{c(CO)}$=106.
解答 解:(1)①C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
②CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
③S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
将方程式①-②-③得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3=-393.5 kJ•mol-1-(+172.5kJ•mol-1-296.0kJ•mol-1)=-270kJ•mol-1 ,
故答案为:-270kJ•mol-1 ;
(2)酸性燃料电池中,负极上燃料失电子生成二氧化碳和水,电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+,
故答案为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)①参加反应的n(CO)=2mol-0.2mol/L×2L=1.6mol,转化率=$\frac{1.6mol}{2mol}×100%$=80%,故答案为:80%;
②浓度商=$\frac{0.4}{0.1×0.{2}^{2}}$=100<160,平衡正向移动,则v正>v逆;
根据表中数据知,反应初始氢气浓度=0.2mol/L+0.4mol/L×2=1.0mol/L,
平衡时c(H2)=0.4mol•L-1,则参加反应的c(H2)=1mol/L-0.4mol•L-1=0.6mol/L,
则氢气的反应速率=$\frac{0.6mol/L}{10min}$=0.06mol/(L.min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以甲醇反应速率为0.03mol/(L.min),
故答案为:>;0.03mol/(L.min);
(4)相同温度下,lg[$\frac{c(CO)}{c(C{O}_{2})}$]越小,说明化学平衡常数越大,还原反应越容易,所以Cu2O最容易被还原;
根据图知,800℃时,lg[$\frac{c(CO)}{c(C{O}_{2})}$]=-6,则化学平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=106,
故答案为:Cu2O;106.
点评 本题考查化学平衡计算、盖斯定律计算、原电池原理等知识点,侧重考查计算能力及基本理论,这些知识点都是高频考点,会根据三段式法进行有关计算,知道浓度商、化学平衡常数与反应方向的关系,题目难度不大.

| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
| A. | 氧化铁常用作红色油漆和涂料 | |
| B. | 司母戊鼎是青铜制品 | |
| C. | 光导纤维的主要成分是硅酸盐 | |
| D. | 常温下可用铁制或铝制容器盛装浓硫酸 |
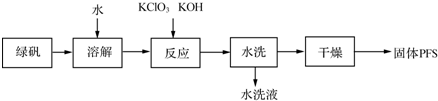
(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.
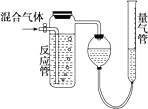 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |

| A. | 形成产物C和D的化学键放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.