题目内容
13.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)═pC(g)达到平衡后,维持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新的平衡后,气体C的浓度为原平衡的1.9倍.则下列说的正确的是( )| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
分析 mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{2}$,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,以此来解答.
解答 解:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{2}$,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,
A.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故A正确;
B.根据以上分析,平衡逆向移动,故B错误;
C.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故C错误;
D.平衡逆向移动,C的质量分数减小,故D错误;
故选A.
点评 本题考查影响平衡移动的因素,注意把握“体积压缩到$\frac{1}{2}$,当达到平衡时C的浓度为原来的1.9倍”为解答的关键信息,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.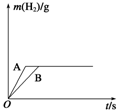 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
8.某同学将盛有25mL一氧化氮、二氧化氮混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中一氧化氮与二氧化氮的体积比是( )
| A. | 2:3 | B. | 3:2 | C. | 4:1 | D. | 1:4 |
18.第ⅠA族的两种元素的原子序数之差不可能是( )
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
2.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是( )
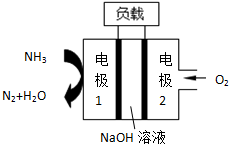

| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
13.炭的化合物有着相当广泛的用途.请回答下列问题:
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率:v(CH3OH)=0.03mol/(L.min);
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

 ),其香味浓郁,被广泛应用于化妆品的制造中.
),其香味浓郁,被广泛应用于化妆品的制造中.