题目内容
2. A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.(1)C的基态原子的价层电子排布式为3d104s2;D和E的电负性大小关系为O>Cl.(用元素符号表示)
(2)化合物E2D分子的空间构型为V形,中心原子采用sp3杂化.E与D还可形成三角锥结构的阴离子,该离子的化学式为ClO3-,任意写出一种它的等电子体的化学式为SO32-.
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃.则该化合物属于分子晶体,晶体内含有的作用力类型有分子间作用力、共价键.
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为CaTiO3.若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为$\frac{\sqrt{2}M}{4{{a}^{3}N}_{A}}$ g/cm3.
分析 A、B、C为金属且同周期,原子序数A<B<C,A、C核外均没有未成对电子,据此判断A、B、C不能为前三周期元素,因为第一周期只有两种元素,第二周期只有2种金属元素,第三周期中Na与Al均存在未成对电子,故A、B、C为第四周期元素,B原子核外有二个未成对电子和三个空轨道,核外电子排布为:[Ar]4s23d2,故B为22号元素:钛;
A、C核外均没有未成对电子,原子序数A<B<C,故A为钙元素,C为锌元素;
E能与D形成化合物ED2,可用于自来水的消毒,且ED均为非金属元素,故E为氯元素,D为氧元素,据此解答各小题即可;
(1)依据元素书写价电子排布,元素的非金属性越强,其电负性越大;
(2)依据价层电子互斥理论计算判断即可;依据等电子体概念书写;
(3)依据熔沸点较低得出是分子晶体,依据分子晶体判断分子间作用力以及化学键;
(4)依据均摊法计算化学式,依据一个晶胞的质量与体积和密度的关系计算密度.
解答 解:A、B、C为金属且同周期,原子序数A<B<C,A、C核外均没有未成对电子,据此判断A、B、C不能为前三周期元素,因为第一周期只有两种元素,第二周期只有2种金属元素,第三周期中Na与Al均存在未成对电子,故A、B、C为第四周期元素,B原子核外有二个未成对电子和三个空轨道,核外电子排布为:[Ar]4s23d2,故B为22号元素:钛;
A、C核外均没有未成对电子,原子序数A<B<C,故A为钙元素,C为锌元素;
E能与D形成化合物ED2,可用于自来水的消毒,且ED均为非金属元素,故E为氯元素,D为氧元素,
(1)C为锌,Zn的基态原子的价层电子排布式为:3d104s2,元素的非金属性越强,其电负性越大,由于非金属性O>Cl,故O和Cl的电负性大小关系为:O>Cl,
故答案为:3d104s2;O;Cl;
(2)化合物E2D为Cl2O,Cl2O分子中中心原子Cl的价电子对数为$\frac{7+1}{2}$=4,中心原子有2对孤电子对,2对σ键,根据价层电子对互斥理论,空间构型为V型,依据sp3杂化,Cl与O形成三角锥结构的阴离子为:ClO3-,它的等电子体的化学式为:SO32-,故答案为:V形;sp3;ClO3-;SO32-;
(3)由题意得出:Ti与Cl形成的化合物为TiCl4,熔点低,沸点低,故该化合物应属于分子晶体,晶体内存在Ti-Cl共价键,分子晶体中存在分子间作用力,
故答案为:分子;分子键作用力、共价键;
(4)依据晶胞结构图可知,晶胞中含有Ca为:1,含有Ti为:8×$\frac{1}{8}$=1,含有O为:6×$\frac{1}{2}$=3,故该晶胞的化学式为:CaTiO3,若最近的Ti与O的原子距离为a cm,那么Ti与Ti的距离即为$\sqrt{2}$a,那么该晶胞的体积为:$(2\sqrt{2}a)^{3}$,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为:$\frac{M}{{N}_{A}×(2\sqrt{2}a)^{3}}=\frac{\sqrt{2}M}{{N}_{A}×4{a}^{3}}$,故答案为:CaTiO3;$\frac{\sqrt{2}M}{4{a}^{3}{N}_{A}}$.
点评 本题主要考查的是位置结构性质的关系与应用,涉及晶体类型判断、晶胞计算、杂化类型判断、等电子体等,综合性较强,有一定难度.


| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
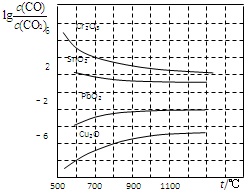
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
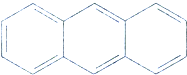 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
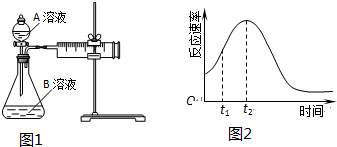
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |