题目内容
8.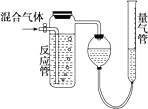 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
分析 反应管内溶液蓝色消失时,SO2与反应管内所含的I2恰好反应,若没及时停止通气,则未反应的SO2气体也排水到量气管,使N2、O2体积增加,测得SO2的含量降低.
解答 解:根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),
SO2的体积百分含量为:φ(SO2)=$\frac{V(S{O}_{2})}{V(混合气体)}$,式中V(SO2)的量是由n(I2)的物质的量决定的,
若“没有及时停止通气”,导致V(混合气体)增大,则二氧化碳的体积分数φ(SO2)偏低,
故选B.
点评 本题考查物质含量的测定、误差分析方法,为高频考点,题目难度中等,明确实验原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
8.某同学将盛有25mL一氧化氮、二氧化氮混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中一氧化氮与二氧化氮的体积比是( )
| A. | 2:3 | B. | 3:2 | C. | 4:1 | D. | 1:4 |
9.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
13.炭的化合物有着相当广泛的用途.请回答下列问题:
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率:v(CH3OH)=0.03mol/(L.min);
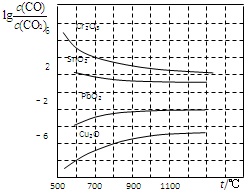
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

20.下列说法正确的是( )
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
17.有机物蒽的结构简式为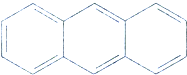 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )
 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
18.已知KClO3+5KCl+3H2SO4=3K2SO4+3Cl2↑+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
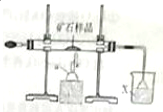 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图: