题目内容
14.下列叙述错误的是( )| A. | 氧化铁常用作红色油漆和涂料 | |
| B. | 司母戊鼎是青铜制品 | |
| C. | 光导纤维的主要成分是硅酸盐 | |
| D. | 常温下可用铁制或铝制容器盛装浓硫酸 |
分析 A、氧化铁为红色俗称为铁红;
B、司母戊鼎是铜与其它金属的合金;
C、光导纤维成分为二氧化硅;
D、铁铝常温下在浓硫酸浓硝酸溶液中发生钝化阻止反应进行.
解答 解:A、氧化铁为红色固体,俗称为铁红,难溶于水,氧化铁常用作红色油漆和涂料,故A正确;
B、我国的司母戊鼎是铜合金,是青铜制品,故B正确;
C、光导纤维的主要成分是二氧化硅,故C错误;
D、铁铝常温下在浓硫酸浓硝酸溶液中发生钝化,表面形成致密氧化物薄膜,阻止反应进行,常温下可用铁制或铝制容器盛装浓硫酸,故D正确;
故选C.
点评 本题考查了物质性质的分析判断,主要是金属氧化物性质分析应用,容易出错的是C选项,注意光导纤维的成分是二氧化硅,铁铝常温下在浓硫酸、浓硝酸中的钝化现象,掌握基础是关键,题目较简单.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
2.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是( )
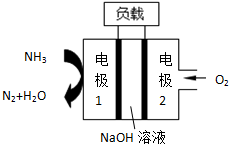

| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
9.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
19.下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
13.炭的化合物有着相当广泛的用途.请回答下列问题:
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率:v(CH3OH)=0.03mol/(L.min);
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

14.位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是( )
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |