题目内容
5.有下列各组物质A.O2和O3
B.12C和13C
C.CH3-CH2-CH2-CH3和
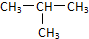
D.H2O和D2O
E.液氯和氯气
F.CO(NH2)2和NH4CNO
G.C60和金刚石
(1)B组两物质互为同位素;
(2)AG组两物质互为同素异形体;
(3)CF组两物质互为同分异构体;
(4)DE组中两物质是同一物质.
分析 A.O2和O3 是氧元素构成的两种不同单质;
B.12C和13C均是碳元素的不同种原子;
C.CH3-CH2-CH2-CH3和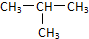 ,属于分子式相同,结构不同的有机化合物;
,属于分子式相同,结构不同的有机化合物;
D.H2O和D2O均是2个H原子和1个O原子构成的水分子;
E.液氯和氯气均是氯气单质;
F.CO(NH2)2和NH4CNO,是分子式相同,结构不同的化合物;
G.C60和金刚石均是碳元素形成的单质,据此解答即可.
解答 解:(1)同位素是质子数相同中子数不同的同元素的不同核素互称同位素,故答案为:B;
(2)同种元素组成的不同单质为同素异形体,故答案为:AG;
(3)分子式相同,结构不同的物质为同分异构体,故答案为:CF;
(4)D.H2O和D2O均是有H与O构成的化合物水,属于一种物质,E.液氯和氯气是氯气的两种状态,属于一种物质,故答案为DE.
点评 本题考查了有机物的命名方法应用,同位素、同素异形体、同系物、同分异构体概念的理解和判断是解题的关键.

练习册系列答案
相关题目
5.下列互为同位素的是( )
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
13.炭的化合物有着相当广泛的用途.请回答下列问题:
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率:v(CH3OH)=0.03mol/(L.min);
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

20.下列说法正确的是( )
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
10.下列说法不正确的是( )
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
17.有机物蒽的结构简式为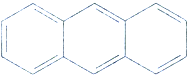 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )
 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
14.位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是( )
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
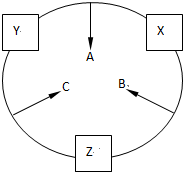 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.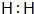
 NH4++OH-.
NH4++OH-.