��Ŀ����
6�����û�ѧ��Ӧԭ����������������⣮��1��������ˮ��Һ�д��ڵ���ƽ�⣬����0.1mol•L-1����ĵ���ƽ�ⳣ�����±���
| ���� | ����ƽ�ⳣ����25�棩 |
| HClO | K=2.98��10-8 |
| H2CO3 | K1=4.3��10-7 K2=5.6��10-11 |
| H2SO3 | K1=1.54��10-2 K2=1.02��10-7 |
���������ӷ���ʽ���й�˵���������ad
a��������CO2ͨ�����������Һ�У�2ClO-+H2O+CO2=2HClO+CO32-
b��������SO2ͨ��̼������Һ�У�SO2+H2O+2CO32-=2HCO3-+SO32-
c����ͬ�¶�ʱ����pH��������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3��
d����ͬ�¶�ʱ�������ʵ�����������������NaOH��Һ��ȫ�к�����NaOH�����Ϊ��V��H2CO3����V��H2SO3����V��HClO��
�������ᣨH2SeO3��Ҳ��һ�ֶ�Ԫ���ᣬ�н�ǿ�������ԣ�����������Һ�в���ͨ��SO2��������ɫ���ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ��H2SeO3+2SO2+H2O=Se��+2H2SO4���÷�Ӧ������������H2SO4��
��2����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����Ƕ����༰��̬ϵͳ�����ܴ���������д������ŷţ�
���ڷ�ˮ�д���ƽ�⣺2CrO42-����ɫ��+2H+?Cr2O72-����ɫ��+H2O���ı�����ʹ����ƽ��������Ӧ�����ƶ���������˵����ȷ����ac
a��ƽ�ⳣ��Kֵ���Բ��ı�
b���ﵽ��ƽ��CrO42-���������ʵ���Cr2O72-����������
c���ٴ�ƽ��ǰ����Ӧ����һ�������淴Ӧ����
d��ƽ���ƶ���ﵽ��ƽ����ҺpHһ������
��Cr2O72-��CrO42-�������ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��?Cr3+��aq��+3OH?��aq�������£�Cr��OH��3���ܶȻ�Ksp=c��Cr3+��•c3��OH-��=10-32����c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��û�У���С���û�С�������������
��3����֪����CO��g��+2H2��g��?CH3OH��g��
��2CH3OH��g��?CH3OCH3��g��+H2O��g��
��CO��g��+H2O��g��?CO2��g��+H2��g��
ij�¶���������Ӧ��ƽ�ⳣ����ֵ����Ϊa1��a2��a3������¶��·�Ӧ 3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g�� �Ļ�ѧƽ�ⳣ��K=a12•a2•a3L4•mol-4���ú�a1��a2��a3�Ĵ���ʽ��ʾ����
��ij�̶�������ܱ������м���3molCO��3molH2����ַ�Ӧ��ָ���ԭ���¶ȣ��ⶨ������ѹǿΪ��Ӧǰ��$\frac{2}{3}$����CO��ת����50%��
���� ��1���ٸ��ݵ���Ϊ���ȹ����жϣ�
���ɱ������ݿ�֪����H2SO3��H2CO3��HSO3-��HClO��HCO3-����HClO���������ԣ�H2SO3���л�ԭ�ԣ�������Ե�ǿ���Լ������ˮ����
������������Һ�в���ͨ��SO2��������ɫ���ʣ�Ӧ����Se��˵�������������������������ԭ��Ӧ���������Se��
��2����ʹƽ��������Ӧ�����ƶ���������Ӧ��Ũ�Ȼ��С������Ũ�ȣ����¶Ȳ��䣬��ƽ�ⳣ�����䣻
�ڵ�c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��c��OH-��=10-10mol/L�����Ksp���㲢�жϣ�
��3��ƽ�ⳣ��������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ�������ʽ���ʱ����ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮�����������ʽ����ʽ���㣮
��� �⣺��1��������ĵ���Ϊ���ȹ��̣����ȴٽ����룬ƽ�ⳣ�����ʴ�Ϊ�����
���ɱ������ݿ�֪����H2SO3��H2CO3��HSO3-��HClO��HCO3-��
a��������CO2ͨ�����������Һ��Ӧ����HCO3-����Ӧ�����ӷ���ʽΪClO-+H2O+CO2=HClO+HCO3-����a����
b��������SO2ͨ��̼������Һ������HCO3-��SO32-�����ӷ���ʽΪSO2+H2O+2CO32-=2HCO3-+SO32-����b��ȷ��
c���ζ�Ӧ���������Խ������ˮ��̶�Խ����ͬ�¶�ʱ����pHʱ����ҺŨ��ԽС������������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3������c��ȷ��
d����ͬ�¶�ʱ�������ʵ�����������������NaOH��Һ��ȫ�кͣ���̼�ᡢ�����ᶼΪ��Ԫ�ᣬ������NaOH�����Ϊ��V��H2CO3��=V��H2SO3����V��HClO������d����
�ʴ�Ϊ��ad��
������������Һ�в���ͨ��SO2��������ɫ���ʣ�Ӧ����Se��˵�������������������������ԭ��Ӧ���������Se������ʽΪH2SeO3+2SO2+H2O=Se��+2H2SO4����Ӧ��SԪ�ػ��ϼ����ߣ���������ΪH2SO4��
�ʴ�Ϊ��H2SeO3+2SO2+H2O=Se��+2H2SO4��H2SO4��
��2����a�����¶Ȳ��䣬��ƽ�ⳣ��Kֵ���Բ��ı䣬��a��ȷ��
b�������ʹ�ϵ�Լ���������֪�ﵽ��ƽ��CrO42-���������ʵ���Cr2O72-���������ʵ�2������b����
c��ƽ��ʱ���淴Ӧ������ȣ�ƽ�������ƶ������ٴ�ƽ��ǰ����Ӧ����һ�������淴Ӧ���ʣ���c��ȷ��
d����������Һ������Ũ�ȣ���ƽ�������ƶ���ƽ���ƶ���ﵽ��ƽ����ҺpHһ����С���ʴ���
�ʴ�Ϊ��ac��
�ڵ�c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��c��OH-��=10-10mol/L��c��Cr3+��•c3��OH-��=10-33��10-32��û�г������ɣ�
�ʴ�Ϊ��û�У�
��3���ɸ�˹���ɿ�֪����Ӧ�١�2+��Ӧ��+��Ӧ����ӵ��ܷ��̣����ܷ��̵�ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮������K=a12•a2•a3��
3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol�� 3 3 x x
ת����mol�� x x $\frac{1}{3}$x $\frac{1}{3}$ x
ƽ�⣨mol�� 3-x 3-x $\frac{1}{3}$x $\frac{1}{3}$ x
������ѹǿΪ��Ӧǰ��$\frac{2}{3}$����$\frac{6-\frac{4x}{3}}{6}$=$\frac{2}{3}$��
x=1.5��
��CO��ת����Ϊ$\frac{1.5}{3}��100%$=50%��
�ʴ�Ϊ��a12•a2•a3��50%��
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ�������ѧ���ķ��������������Ŀ��飬��Ŀ�漰��˹����Ӧ�á�������ʵĵ��롢ƽ�ⳣ���ļ���Ӧ�õ�֪ʶ��ע�⣨3������ʽ���ʱ����ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮������1���DZ�����״����Ƶ���㣬��Ŀ�Ѷ��еȣ�

| A�� | KAl��SO4��2��Һ��c��SO42-����c��K+��=c��Al3+����c��H+����c��OH-�� | |
| B�� | �÷�̪��ָʾ������ˮ�е�����������ζ��յ㣺c��NH4+����c��Cl-�� | |
| C�� | NH4Cl��Ba��NO3��2�Ļ����Һ��c��Cl-��+2c��NO3-��=c��NH4+��+c��NH3•H2O��+c��Ba2+�� | |
| D�� | ������ˮ�У�c��H+��=2c��ClO-��+c��HClO��+c��OH-�� |
 ��ʯ�������Ѿ������е�һ���л��ᣬ���ѾƵ�pH��Ҫȡ���ھ�ʯ��ĺ��������������Ѿ�pHԼΪ2.9-3.8�������£���ʯ�ᣨ��H2T��ʾ��ˮ��Һ����������ռ������a����pH��ϵ��ͼ��ʾ�����б�������ȷ�ǣ�������
��ʯ�������Ѿ������е�һ���л��ᣬ���ѾƵ�pH��Ҫȡ���ھ�ʯ��ĺ��������������Ѿ�pHԼΪ2.9-3.8�������£���ʯ�ᣨ��H2T��ʾ��ˮ��Һ����������ռ������a����pH��ϵ��ͼ��ʾ�����б�������ȷ�ǣ�������| A�� | �����£�H2T?H++HT- Ka=10-3 | |
| B�� | ��HT-��T2-���ʵ���Ũ�����ʱ����Һ��ˮ�������H+Ũ�ȴ��ڴ�ˮ��H+��Ũ�� | |
| C�� | �����ѾƵ�pHΪ3.7ʱ��HT-��ռ�����ﵽ���ʱ���Ѿ���c��H2T����c��T2-�� | |
| D�� | ���Ѿ��г��˴��ھ�ʯ���⣬�����ھ�ʯ���� |
| A�� | Y�γɵļ����Ӱ뾶С��Z�γɵļ����Ӱ뾶 | |
| B�� | X���⻯���ȶ�������Y���⻯���ȶ��� | |
| C�� | ����Ԫ���У�W���������Ӧ��ˮ����������ǿ | |
| D�� | Y��Z�γɵ����ֻ������������л�ѧ��������ͬ |
| A�� | ʳƷ����Ĥ��һ����ʳƷ������Ҫ�ɷ��Ǿ���ϩ | |
| B�� | �ڼ���ȼú�м�����������ʯ������Ч���ٶ���������ŷ��� | |
| C�� | ��ʹ����������ˮ���ܴﵽ����ɱ���ͳ�ȥ�������ʵ�Ŀ�� | |
| D�� | һ��Ũ�ȵ�˫��ˮ�������˿ڵ����� |
| A�� | SO2 | B�� | NaHSO3 | C�� | CH3COONa | D�� | FeCl2 |

| A�� | ��l mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к��� | |
| B�� | ;��������O2Ũ�ȿ����SO2ת���� | |
| C�� | ;������SO2��SO3���������������� | |
| D�� | ����Hl����H2+��H3����2H2O2��aq��=2H2O��1��+O2 ��g��Ϊ���ȷ�Ӧ |
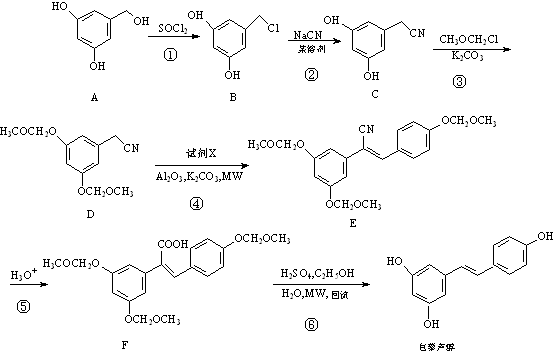
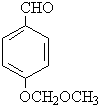 ��
��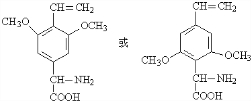 ����дһ�֣���
����дһ�֣���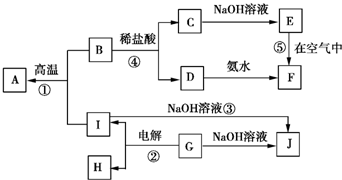 A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮������ϵ��ͼ��ʾ�����ַ�Ӧ�������û���г�������A��B��C��D��E��F���������о���ͬһ��Ԫ�أ�
A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮������ϵ��ͼ��ʾ�����ַ�Ӧ�������û���г�������A��B��C��D��E��F���������о���ͬһ��Ԫ�أ�