题目内容
11.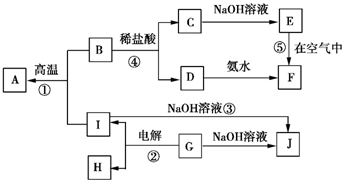 A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.
A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为第四周期第Ⅷ族.
(2)反应②阳极的电极反应式为2O2--4e-=O2↑,反应③的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应⑤的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)实验室配制C溶液时通常要加入少量的铁屑和稀盐酸;将少量D的浓溶液滴入沸水中得到的液体呈红褐色,再逐滴滴加盐酸时,产生的现象是先产生红褐色沉淀,后溶解得到黄色溶液;
(4)反应①中每生成3mol A,转移电子的物质的量为8mol.
分析 电解G得到I和H,G能和氢氧化钠溶液反应生成J,I也能与氢氧化钠反应生成J,则G是Al2O3,I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,据此答题.
解答 解:G电解G得到I和H,G能和氢氧化钠溶液反应生成J,I也能与氢氧化钠反应生成J,则G是Al2O3,I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,
(1)推断可知,A、B、C、D、E、F六种物质中所含的同一种元素为铁元素,在周期表中的位置为第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)电解氧化铝的阳极的电极反应式为2O2--4e-=O2↑,反应③的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应⑤的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案 为:2O2--4e-=O2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)实验室配制FeCl2溶液时,为防止亚铁离子被空气中的氧气氧化和亚铁离子的水解,通常要加入少量的铁屑和稀盐酸,将少量FeCl3的浓溶液滴入沸水中得到的氢氧化铁胶体,液体呈红褐色,再逐滴滴加盐酸时,先发生胶体的聚沉,后氢氧化铁沉淀溶解,所以产生的现象是先产生红褐色沉淀,后溶解得到黄色溶液,
故答案为:铁屑和稀盐酸;红褐;先产生红褐色沉淀,后溶解得到黄色溶液;
(4)根据电子得失守恒及铝热反应的方程式可知,反应①中每摩尔Fe3O4生成3mol Fe,转移电子的物质的量为8mol,故答案为:8mol.
点评 本题考查无机物的推断,注意推断的关键点:①在电解条件下生成I和H,能与NaOH溶液反应,说明为Al2O3,②铝和B高温下发生反应,说明为铝热反应,再结合物质的其它性质分析解答,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
| A. | 0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | pH=12的溶液K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:K+、NH4+、HCO3-、Cl- | |
| D. | 酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
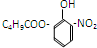 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
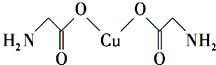
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式
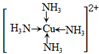 (标出配位键);
(标出配位键);深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
| A. | 碳化钙(CaC2)的电子式:Ca2+[:C::C:]2- | |
| B. | ${\;}_{8}^{18}$O2-离子的结构示意图: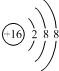 | |
| C. | 2-甲基-2-丙醇的结构简式: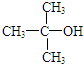 | |
| D. | Na2S水解的离子方程式:S2-+2H2O?2H2S+2OH- |
| A. | 地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”为不同类别的分散系 | |
| C. | 太阳光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | PbO2具有氧化性和导电性,可用作铅蓄电池正极材料 |