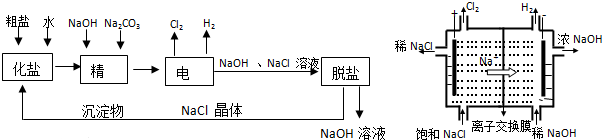
题目内容
14.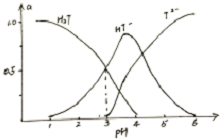 酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )
酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )| A. | 常温下,H2T?H++HT- Ka=10-3 | |
| B. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中c(H2T)<c(T2-) | |
| D. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 |
分析 A.根据H2T?H++HT-、Ka=$\frac{c({H}^{+})•c(H{T}^{-})}{c({H}_{2}T)}$进行计算;
B.由图象可知,当HT-和T2-物质的量浓度相等时溶液的pH大于3小于4,呈酸性,抑制水的电离,据此分析;
C.由图象可知,当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T<T2-;
D.由图象可知,当溶液中pH约为2.9~3.8,溶液主要为HT-.
解答 解:A.因为平衡常数K仅与温度有关,所以取溶液pH为3时,当HT-和H2T物质的量浓度相等,则H2T?H++HT-,Ka=$\frac{c({H}^{+})•c(H{T}^{-})}{c({H}_{2}T)}$=c(H+)=10-3,故A正确;
B.由图象可知,当HT-和T2-物质的量浓度相等时,溶液的pH<4,呈弱酸性,抑制水的电离,所以此时溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度,故B错误;
C.根据图象可知,当葡萄酒的pH为3.7时,HT-所占分数达到最大,且c(H2T)<c(T2-),故C正确;
D.由图象可知,当溶液中pH约为2.9~3.8,溶液主要为HT-,所以葡萄酒中除了存在酒石酸外,还存在酒石酸盐,故D正确;
故选B.
点评 本题以图象的形式考查平衡常数的计算、离子浓度比较、影响水的电离因素等至少,题目难度中等,需要学生具有扎实的基础与读图获取信息的能力,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | pH=12的溶液K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:K+、NH4+、HCO3-、Cl- | |
| D. | 酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
9.化学与人类生活、社会发展密切相关.下列说法不正确的是( )
| A. | 为了保证食物的安全与色香味,我们应该研发高效低毒的农药,科学使用食品添加剂,并用聚乙烯塑料袋进行包装 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和 CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,但不能提高该反应的平衡转化率 | |
| C. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 推广乙醇汽油,CO2的捕捉与封存都符合低碳经济与低碳生活 |
19.对于结构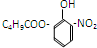 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )
 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
6.运用化学反应原理分析解答以下问题.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
①当弱酸的浓度一定时,升高温度,K值变大(填“变大”、“变小”或“不变”).
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
3. (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
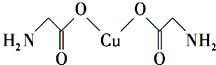
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能.
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式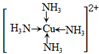 (标出配位键);
(标出配位键);
深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式
 (标出配位键);
(标出配位键);深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的数目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共价键数目为0.8 NA | |
| C. | 标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA | |
| D. | 0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
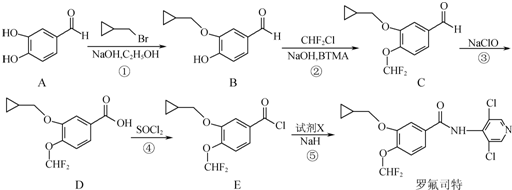
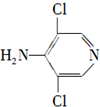 .
.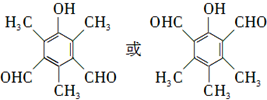 等.
等.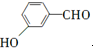 、CH3CH2OH为原料制备
、CH3CH2OH为原料制备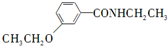 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: