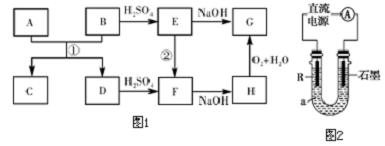
题目内容
18.化学与生产、生活、社会密切相关,下列叙述错误的是( )| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
分析 A.聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分;
B.二氧化硫可导致酸雨;
C.氯气可用于杀菌消毒,胶体能吸附悬浮杂质;
D.双氧水有强氧化性.
解答 解:A.聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分,故A正确;
B.在家用燃煤中加入适量的生石灰,二氧化硫与生石灰反应最终生成硫酸钙,可减少二氧化硫的排放,故B正确;
C.氯气可用于杀菌消毒,但是不能去除悬浮杂质,故C错误;
D.双氧水有强氧化性,可用来杀菌消毒,故D正确;
故选C.
点评 本题考查较为综合,涉及环境污染、塑料、氯气的性质、双氧水的性质等知识,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.化学与人类生活、社会发展密切相关.下列说法不正确的是( )
| A. | 为了保证食物的安全与色香味,我们应该研发高效低毒的农药,科学使用食品添加剂,并用聚乙烯塑料袋进行包装 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和 CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,但不能提高该反应的平衡转化率 | |
| C. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 推广乙醇汽油,CO2的捕捉与封存都符合低碳经济与低碳生活 |
6.运用化学反应原理分析解答以下问题.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
①当弱酸的浓度一定时,升高温度,K值变大(填“变大”、“变小”或“不变”).
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
3. (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
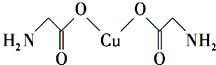
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能.
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式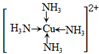 (标出配位键);
(标出配位键);
深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式
 (标出配位键);
(标出配位键);深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
10.分子式为C6H14O且在铜或银做催化剂的条件下,可以被空气中的氧气氧化成醛的醇有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
7.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
16.A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如表:
试回答以下问题:
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为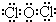 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为
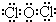 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
 W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:
W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题: