题目内容
9.下列关于溶液中常见离子的检验及结论正确的是( )| A. | 加入AgNO3溶液有白色沉淀产生,一定有Cl- | |
| B. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
分析 A.加入AgNO3溶液有白色沉淀产生,沉淀可能为AgCl、Ag2CO3、Ag2SO4等;
B.可能生成AgCl沉淀;
C.能使湿润红色石蕊试纸变蓝的气体一定为氨气;
D.也可能为Ca2+.
解答 解:A.加入AgNO3溶液有白色沉淀产生,沉淀可能为AgCl、Ag2CO3、Ag2SO4等,应先加入硝酸酸化,在加入硝酸银检验,故A错误;
B.检验硫酸根离子,可先加入盐酸,如无现象,再加入氯化钡检验,否则不能排出生成AgCl沉淀,故B错误;
C.能使湿润红色石蕊试纸变蓝的气体一定为氨气,说明溶液中存在NH4+,故C正确;
D.也可能为Ca2+,如检验钡离子,应加入硫酸钠,再加入硝酸检验,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,侧重实验操作和实验原理、检验试剂的选择考查,注意实验方案的操作性、评价性的分析,题目难度不大.

练习册系列答案
相关题目
20.已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
C6H5CHO(苯甲醛)+(CH3CO)2O→C6H5CH=CHCOOH(肉桂酸)+A
(1)上述反应式中,反应物的物质的量之比为1:1.产物A的名称是乙酸.
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其结构简式为C6H5CH=CHCOOC2H5,关于它的说法正确的是abcd.
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.在酸性或碱性条件下可以水解 d.属于芳香烃的衍生物
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
可见,取代基对Perkin反应的影响有(写出2条即可):①氯原子离醛基越远,对反应越不利(或氯原子取代时,邻位最有利,对位最不利)②苯环上氯原子越多,对反应越有利.
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氮化钯催化下可直接合成肉桂酸乙酯,该反应属于Heck反应,是环B的一种取代反应,其反应方程式为(不要求标出反应条件)C6H5Br+CH2=CHCOOC2H5→C6H5CH=CHCOOC2H5+HBr
(5)Heck反应中,为了促进反应的进行,通常可加入一种显B(填字母)的物质,原因是弱碱中和HBr,降低了反应物的浓度,能促使平衡向右移动.A.弱酸性 B.弱碱性 C.中性 D.强酸性.
C6H5CHO(苯甲醛)+(CH3CO)2O→C6H5CH=CHCOOH(肉桂酸)+A
(1)上述反应式中,反应物的物质的量之比为1:1.产物A的名称是乙酸.
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其结构简式为C6H5CH=CHCOOC2H5,关于它的说法正确的是abcd.
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.在酸性或碱性条件下可以水解 d.属于芳香烃的衍生物
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
| 取代苯甲醛 | 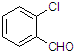 | 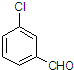 | 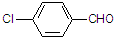 | 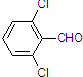 |
| 产率(%) | 71 | 63 | 52 | 82 |
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氮化钯催化下可直接合成肉桂酸乙酯,该反应属于Heck反应,是环B的一种取代反应,其反应方程式为(不要求标出反应条件)C6H5Br+CH2=CHCOOC2H5→C6H5CH=CHCOOC2H5+HBr
(5)Heck反应中,为了促进反应的进行,通常可加入一种显B(填字母)的物质,原因是弱碱中和HBr,降低了反应物的浓度,能促使平衡向右移动.A.弱酸性 B.弱碱性 C.中性 D.强酸性.
17.已知相同浓度的NH4Cl和FeCl3溶液pH是前者小于后者,在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A. | Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
4.下列文字表述与反应的离子方程式对应且正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO2↑+14H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
14.在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色.为了探究溶液变为黄色的原因,甲、乙两位同学提出了不同的观点:
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或不可行)不可行;,理由是因为Br2和Fe3+都能把I-氧化成I2
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
1.在制备硝酸钾晶体实验中,先后进行了二次过滤,分别是( )
| A. | 先热过滤,后常温减压过滤 | B. | 先常温常压过滤,后常温减压过滤 | ||
| C. | 先常温减压过滤,后热过滤 | D. | 两次都用减压过滤 |
18.决定化学反应速率的主要因素是( )
| A. | 反应物的浓度 | B. | 温度、压强以及反应物的接触面积 | ||
| C. | 催化剂 | D. | 参加反应的物质本身的性质 |