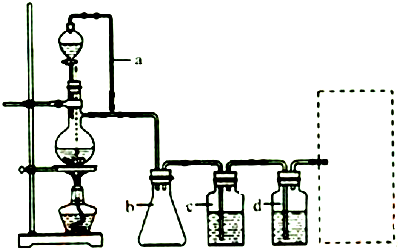
题目内容
17.已知相同浓度的NH4Cl和FeCl3溶液pH是前者小于后者,在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )| A. | Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
分析 NH4Fe(SO4)2可以写成(NH4)2SO4•Fe2(SO4)3的形式,向NH4Fe(SO4)2溶液中加入Ba(OH)2溶液时,OH-先和Fe3+反应,再和NH4+反应,
A.NH4Fe(SO4)2中Fe的化合价是+3价;
B.氢氧化钡过量,反应生成硫酸钡、氢氧化铁和一水合氨;
C.氢氧化钡不足时反应生成硫酸钡和氢氧化铁;
D.当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际.
解答 解:A.复盐NH4Fe(SO4)2中,铁元素为三价,故A错误;
B.NH4Fe(SO4)2完全反应消耗氢氧化钡的物质的量为2mol,反应的离子方程式为NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O,故B正确;
C.氢氧化钡不足时反应生成硫酸钡和氢氧化铁,离子方程式:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓,故C正确;
D.当加入3molBa(OH)2时,氢氧化钡过量,离子方程式:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O,故D错误;
故选:BC.
点评 本题考查了离子方程式的书写,侧重考查反应物用量对离子方程式书写的影响,题目难度中等.

练习册系列答案
相关题目
20.下列叙述中,错误的是( )
| A. | 乙烯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
8.下列说法不正确的是( )
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油分馏、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 氟氯代烷化学性质稳定、无毒,具有不燃烧、易挥发、易液化等特性 |
9.下列关于溶液中常见离子的检验及结论正确的是( )
| A. | 加入AgNO3溶液有白色沉淀产生,一定有Cl- | |
| B. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
6.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||||||
| C. | 已知某些化学键的键能数据如下表:
| |||||||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
7.下列关于丙烯(CH3-CH=CH2)的说法正确的是( )
| A. | 丙烯分子有8个σ键,1 个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子可能在同一直线上 |
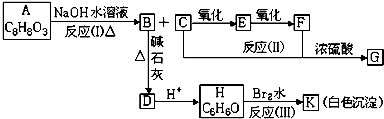
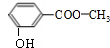 ,EHCHO.
,EHCHO.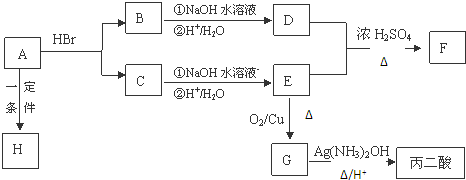
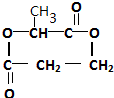 .
.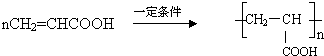 .
.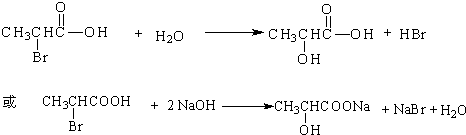 ,其反应类型是取代或水解反应.
,其反应类型是取代或水解反应.