题目内容
4.下列文字表述与反应的离子方程式对应且正确的是( )| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO2↑+14H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
分析 A.硫离子水解生成硫氢根离子和氢氧根离子;
B.稀硝酸还原产物为一氧化氮;
C.溶液中氢离子物质的量等于氢氧根离子的物质的量;
D.发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子.
解答 解:A.硫化钠的水解反应,离子方程式:S2-+H2O HS-+OH-,故A错误;
B.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故B错误;
C.NaHSO4溶液与Ba(OH)2溶液混合后显中性,离子方程式2H++2SO42-+Ba2++2OH-=2BaSO4↓+2H2O,故C错误;
D.NaNO2溶液中加入酸性KMnO4溶液,离子方程式:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质、熟悉离子反应方程式的书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
7.法国化学家伊夫•肖万获2005年诺贝尔化学奖.他发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应(该过程可发生在不同烯烃分子间,也可发生在同种烯烃分子间).如:
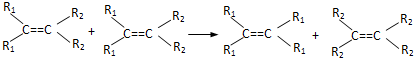
则对于有机物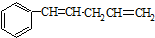 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )

则对于有机物
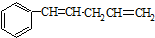 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )| A. | 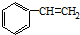 | B. | 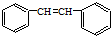 | C. | CH2=CHCH3 | D. | 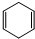 |
19.下列实验装置或操作不符合实验要求的是( )
| A. | 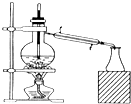 石油分馏 | B. | 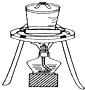 灼烧干海带 | ||
| C. | 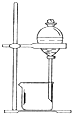 用CCl4提取碘水中的碘 | D. |  冶炼金属铁 |
9.下列关于溶液中常见离子的检验及结论正确的是( )
| A. | 加入AgNO3溶液有白色沉淀产生,一定有Cl- | |
| B. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
16.以下变化是熵减小过程的是( )
| A. | 碳酸氢钠受热分解 | B. | 氨气与氯化氢气体反应 | ||
| C. | C(s,石墨)+H2O(g)═CO(g)+H2(g) | D. | 液态水气化 |
13.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |

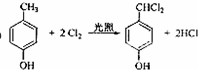 ,该反应类型为取代反应.
,该反应类型为取代反应.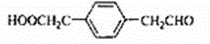 等.
等.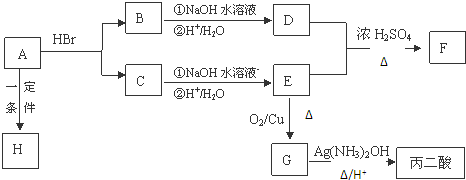
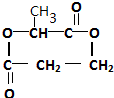 .
.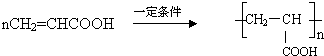 .
.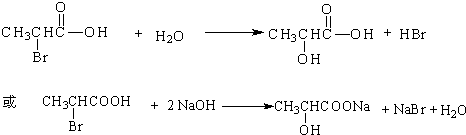 ,其反应类型是取代或水解反应.
,其反应类型是取代或水解反应.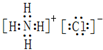 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.