题目内容
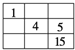
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
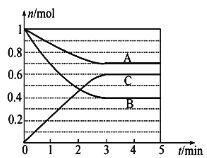
(1)该反应的化学方程式为__________。
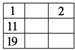
(2)该反应的反应速率v随时间t的关系如图所示:
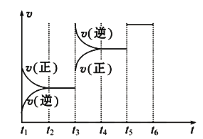
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
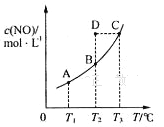
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
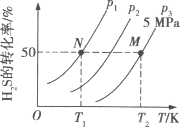
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。
【答案】A + 2B ![]() 2C 升高温度 t2~t3 K1 > K2 = K3 > p3>p2>p1 1 及时分离出产物
2C 升高温度 t2~t3 K1 > K2 = K3 > p3>p2>p1 1 及时分离出产物
【解析】
(1)根据3min达到平衡时A、B、C的物质的量变化判断反应物、生成物,然后根据物质的量变化与化学计量数成正比写出反应的化学方程式;
(2)①t3时逆反应速率正逆反应速率同时增大,且逆反应速率大于正反应速率,说明平衡向着逆向移动,据此进行判断改变的反应条件;
②t1~t2时反应向着正向移动,A转化率逐渐增大,直至t2~t3时A到平衡状态,A转化率达到最大;而t3~t4时升高了温度,平衡向着逆向移动,A的转化率减小,直至t4~t5时A的转化率达到最低;而t5~t6时正逆反应速率同时增大且相等,说明平衡不移动,A的转化率不变,据此进行解答;
③化学平衡常数与温度有关,温度越高,平衡向着逆向移动,该反应的平衡常数减小;
Ⅱ.(1)同一压强下升高温度H2S转化率的变化判断平衡移动方向,从而判断焓变大小;
同一温度下不同压强H2S转化率的变化判断平衡移动方向,从而判断压强大小;
(2)依据化学平衡移动原理可知压强增大平衡向气体体积减小的方向进行;
(3)结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率。
Ⅰ.(1)根据图象可知,达到平衡时A的物质的量减小了:1mol-0.7mol=0.3mol,B的物质的量减小为:1mol-0.4mol=0.6mol,C的物质的量增加,增加的物质的量为:0.6mol,所以A、B、C的物质的量变化之比为:0.3mol:0.6mol:0.6mol=1:2:3,该反应的化学方程式为:A+2B2C;
(2)①根据图象可知:t3时逆反应速率正逆反应速率同时增大,且逆反应速率大于正反应速率,说明平衡向着逆向移动,若增大压强,平衡向着正向移动,由于该反应为放热反应,升高温度后平衡向着逆向移动,所以t3时升高了温度;
②根据图象变化可知,在t1~t2时反应向着正向移动,A转化率逐渐增大,直至t2~t3时反应达到平衡状态,A转化率达到最大;而t3~t4时升高了温度,平衡向着逆向移动,A的转化率逐渐减小,直至t4~t5时A的转化率达到最低;而t5~t6时正逆反应速率同时增大且相等,说明平衡没有移动,A的转化率不变,与t4~t5时相等,所以A的转化率最低的时间段是:t2~t3;
③反应A+2B2C △H<0,温度升高平衡向着逆反应方向移动,化学平衡常数减小,所以温度越高,化学平衡常数越小;t2~t3、t3~t4、t4~t5时间段的温度关系为:t3~t4=t4~t5>t2~t3,所以化学平衡常数大小关系为:K1>K2=K3;
Ⅱ.(1)如图所示,同一压强下,升高温度,H2S气体分解生成H2(g)和S2(g)的平衡转化率增大,则升高温度平衡正向移动,正反应为吸热反应,△H>0;
(2)2H2S(g)2H2(g)+S2(g)△H=+169.8kJmol﹣1,反应是气体体积增大的反应,温度不变,压强增大平衡逆向进行,H2S的转化率减小,则压强关系为:P1<P2<P3;
(3)M点的H2S转化率为50%,总压为5MPa,设H2S起始量为2mol,
2H2S(g)2H2(g)+S2(g)
起始量(mol) 2 0 0
变化量(mol) 1 1 0.5
平衡量(mol) 1 1 0.5
Kp=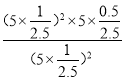 =1;
=1;
(3)如果想进一步提高H2S的转化率,除改变温度、压强外,可以减少生成物浓度促进平衡正向进行,提高硫化氢的转化率,采取的措施有及时分离出产物。

 优学名师名题系列答案
优学名师名题系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空:
(1)硫原子的核外电子排布式为__,硫原子的核外电子占有__个轨道,Z元素在元素周期表中的位置为__,Y原子核外有______种能量不同的电子。
(2)H2S分子中H-S键键角为92°,说明H2S分子是__(填“极性”“非极性”)分子。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫单质得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成0.1molX的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(5)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:___;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因___。