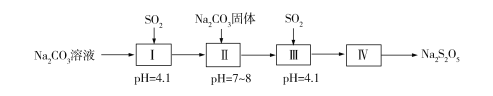
题目内容
【题目】下列说法不正确的是( )
A.已知冰的熔化热为![]()
![]() ,冰中氢键键能为20
,冰中氢键键能为20![]() ,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中
,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中![]() 的氢键
的氢键
B.已知:![]() 石墨
石墨![]() ,
,![]()
![]() .
.![]() ,
,![]()
![]() .
.![]() 石墨
石墨![]() ,
,![]()
![]() .则
.则![]() ,
,![]()
![]()
C.实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧热分别为
的标准燃烧热分别为![]()
![]() 、
、![]()
![]() 和
和![]()
![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为![]() ,
,![]() 若加入少量醋酸钠固体,则
若加入少量醋酸钠固体,则![]() 向左移动,
向左移动,![]() 减小,Ka变小
减小,Ka变小
【答案】D
【解析】
![]() 冰是由水分子通过氢键形成的分子晶体,冰的熔化热为
冰是由水分子通过氢键形成的分子晶体,冰的熔化热为![]() ,1mol冰变成
,1mol冰变成![]() 的液态水所需吸收的热量为
的液态水所需吸收的热量为![]() ,全用于打破冰的氢键,冰中氢键键能为
,全用于打破冰的氢键,冰中氢键键能为![]() ,1mol冰中含有2mol氢键,需吸收
,1mol冰中含有2mol氢键,需吸收![]() 的热量,
的热量,![]() 由计算可知,最多只能打破1mol冰中全部氢键的
由计算可知,最多只能打破1mol冰中全部氢键的![]() ,故A正确;
,故A正确;
B.![]() 石墨
石墨![]() ;
;![]()
![]()
![]() ;
;![]()
![]()
![]() 石墨
石墨![]() ;
;![]()
![]()
![]() ;
;![]()
![]()
根据盖斯定律,方程式![]() 可由
可由![]() 可得,
可得, ![]()
![]()
![]()
![]()
![]() ,故B正确;
,故B正确;
C.实验测得环己烷![]() 和环己烯
和环己烯![]() 的标准燃烧热分别为
的标准燃烧热分别为![]() 和
和![]() ,1mol环己烯
,1mol环己烯![]() 与环己烷
与环己烷![]() 相比,形成1mol碳碳双键,能量降低169kJ,假如苯分子中有独立的碳碳双键,苯
相比,形成1mol碳碳双键,能量降低169kJ,假如苯分子中有独立的碳碳双键,苯![]() 与环己烷
与环己烷![]() 相比,形成三个碳碳双键,则能量应降低
相比,形成三个碳碳双键,则能量应降低![]() ,而实际测得苯的燃烧热仅为3265
,而实际测得苯的燃烧热仅为3265![]() ,能量降低了3916
,能量降低了3916![]()
![]() ,远大于
,远大于![]() ,充分说明苯分子不是环己三烯的结构,可以证明在苯分子中不存在独立的碳碳双键,故C正确;
,充分说明苯分子不是环己三烯的结构,可以证明在苯分子中不存在独立的碳碳双键,故C正确;
D.Ka是电离常数,是弱电解质达电离平衡时的平衡常数,在一定温度下,与浓度无关.Ka的计算用溶液中电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值,一定温度下,醋酸溶液的物质的量浓度为c,电离度为![]() ,
,![]() 醋酸电离出的
醋酸电离出的![]() 和
和![]() 浓度均为
浓度均为![]() ,溶液中未电离的电解质分子浓度为
,溶液中未电离的电解质分子浓度为![]() ,故题中
,故题中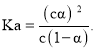 若加入少量醋酸钠固体,
若加入少量醋酸钠固体,![]() 增大了
增大了![]() 的浓度,
的浓度,![]() 向左移动,
向左移动,![]() 减小,但是温度不变,则Ka不变,故D错误。
减小,但是温度不变,则Ka不变,故D错误。
答案:D。

 阅读快车系列答案
阅读快车系列答案【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:
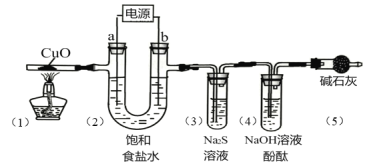
对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
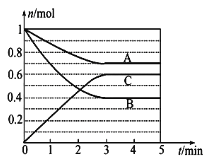
(1)该反应的化学方程式为__________。
(2)该反应的反应速率v随时间t的关系如图所示:
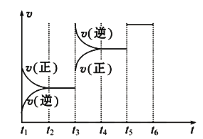
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
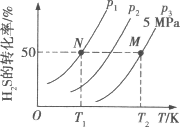
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。