题目内容
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
【答案】BCDF MnO2 Cl2 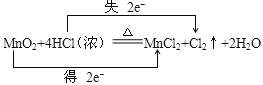 0.3
0.3
【解析】
(1)根据氧化还原反应中存在元素化合价的升降分析判断;
(2)在氧化还原反应中,化合价降低元素所在反应物是氧化剂,化合价升高元素所在反应物是还原剂,化合价升高值=化合价降低值=转移电子数,据此分析解答。
(1)A.(NH4)2SO3 ![]() 2NH3↑+H2O+SO2↑ 各元素化合价不变,所以不属于氧化还原反应,故错误;
2NH3↑+H2O+SO2↑ 各元素化合价不变,所以不属于氧化还原反应,故错误;
B.2CO+O2 ![]() 2CO2中C、O元素化合价变化,属于氧化还原反应,故正确;
2CO2中C、O元素化合价变化,属于氧化还原反应,故正确;
C.2C+SiO2 ![]() Si+2CO↑中C、Si元素化合价变化,属于氧化还原反应,故正确;
Si+2CO↑中C、Si元素化合价变化,属于氧化还原反应,故正确;
D.NH4NO3 ![]() N2O+2H2O中N元素化合价变化,属于氧化还原反应,故正确;
N2O+2H2O中N元素化合价变化,属于氧化还原反应,故正确;
E.CaCO3+CO2+H2O=Ca(HCO3)2各元素化合价不变,所以不属于氧化还原反应,故错误;
F.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中Mn、Cl元素化合价变化,属于氧化还原反应,故正确;
MnCl2+Cl2↑+2H2O中Mn、Cl元素化合价变化,属于氧化还原反应,故正确;
属于氧化还原反应的有BCDF,故答案为:BCDF;
(2)①在MnO2+4HCl (浓)![]() MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氧化剂为MnO2,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,故答案为:MnO2;Cl2;
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氧化剂为MnO2,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,故答案为:MnO2;Cl2;
②反应中转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: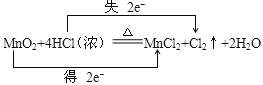 ,故答案为:
,故答案为: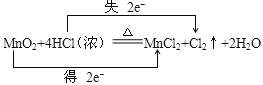 ;
;
③根据氯原子守恒,若产生了标准状况下3.36升的氯气,则被氧化的HCl的物质的量为![]() ×2=0.3mol,故答案为:0.3。
×2=0.3mol,故答案为:0.3。

 阅读快车系列答案
阅读快车系列答案