题目内容
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
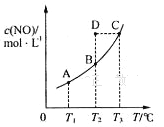
A.该反应的△H>0
B.在T2时,若 反 应 体 系 处于 状 态D ,则 此 时v正>v逆
C.若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
【答案】B
【解析】
A、随温度升高NO浓度升高,平衡逆向移动,该反应的△H<0,A错误;
B、在T2时,若反应体系处于状态D,则此时要达到平衡状态,反应需正向进行,所以v正>v逆,B正确;
C、温度越高压强越大,PC>PD=PB,C错误;
D、随温度升高NO浓度升高,平衡逆向移动,平衡常数减小,K1>K2,D错误。
答案选B。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
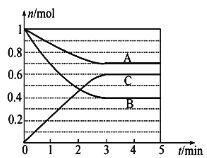
(1)该反应的化学方程式为__________。
(2)该反应的反应速率v随时间t的关系如图所示:
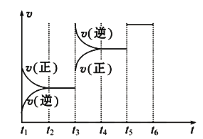
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
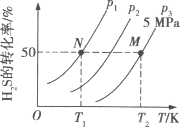
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。