题目内容
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用___上的特征谱线来鉴定元素。
(2)![]() 、
、![]() 、
、![]() 都是重要的有机反应中间体。
都是重要的有机反应中间体。![]() 中碳原子的杂化方式为_______,
中碳原子的杂化方式为_______,![]() 的空间构型为_____。
的空间构型为_____。
(3)![]() 和
和![]() 互为等电子体,电离能
互为等电子体,电离能![]() ___
___![]() (填“>”或“<”)。
(填“>”或“<”)。
(4)工业上制取单质氟可通过电解![]() 和
和![]() 的混合溶液获得,与
的混合溶液获得,与![]() 互为等电子体的分子为_____(任填一种)。
互为等电子体的分子为_____(任填一种)。
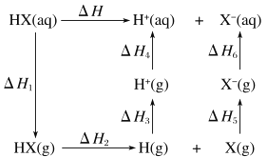
(5)氢卤酸(![]() )的电离过程如图。
)的电离过程如图。![]() 和
和![]() 的递变规律都是
的递变规律都是![]() ,其中
,其中![]() 特别大的原因为__________,从原子结构分析影响
特别大的原因为__________,从原子结构分析影响![]() 递变的因素为_____。
递变的因素为_____。
【答案】原子光谱 ![]() 三角锥形 > CO2 HF的水溶液中存在氢键 原子半径
三角锥形 > CO2 HF的水溶液中存在氢键 原子半径
【解析】
![]() 现代化学中,常利用原子光谱上的特征谱线来鉴定元素,故答案为:原子光谱;
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,故答案为:原子光谱;![]() 中心碳原子孤电子对数
中心碳原子孤电子对数![]() ,杂化轨道数目
,杂化轨道数目![]() ,C原子采取
,C原子采取![]() 杂化。
杂化。![]() 中的碳原子形成3个
中的碳原子形成3个![]() 键,孤电子对数
键,孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,C原子采取sp3杂化,但是一对孤电子占据一条轨道,所以其空间构型为三角锥形,故答案为:
,C原子采取sp3杂化,但是一对孤电子占据一条轨道,所以其空间构型为三角锥形,故答案为:![]() ;三角锥形;
;三角锥形;![]() 正电性比Ne的高,
正电性比Ne的高,![]() 对核外电子吸引更大,更难失去电子,故电离能
对核外电子吸引更大,更难失去电子,故电离能![]() ,故答案为:
,故答案为:![]() ;
;
(4)价电子数和原子个数都相同的分子或离子互为等电子体,![]() 价电子数为16,可用O替换F,2个O有12个价电子,再加价电子为4的C即可,即CO2,故答案为:CO2;
价电子数为16,可用O替换F,2个O有12个价电子,再加价电子为4的C即可,即CO2,故答案为:CO2;![]() 克服分子之间的相互作用,HF的水溶液中存在氢键作用,分子之间相互作用很强,
克服分子之间的相互作用,HF的水溶液中存在氢键作用,分子之间相互作用很强,![]()
![]() 特别大。
特别大。![]() 克服化学键,原子半径越小,键长越短,键能越大,克服化学键需要能量越多,则影响
克服化学键,原子半径越小,键长越短,键能越大,克服化学键需要能量越多,则影响![]() 递变的因素为:原子半径,故答案为:HF的水溶液中存在氢键作用;原子半径。
递变的因素为:原子半径,故答案为:HF的水溶液中存在氢键作用;原子半径。

【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
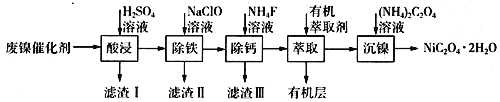
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
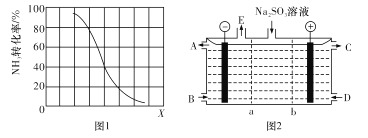
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大