题目内容
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

【答案】 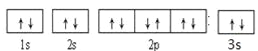 A1<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 sp2 V形 Cu3N
A1<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 sp2 V形 Cu3N ![]()
【解析】C元素是地壳中含量最高的金属元素,所以C是Al元素,D原予核外的M层中有两对成对电子,且D的原子序数大于C,所以D是S元素,E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,E的原子序数大于16,所以E是Cu元素,A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素.
(1)B是Mg元素,核电荷数为12,根据核外电子排布规律B的轨道排布式是![]() ,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N。故答案为:
,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N。故答案为:  、 A1<Mg<S<N
、 A1<Mg<S<N
(2)氯化镁是离子晶体,氯化铝是分子晶体,所以离子晶体的熔点远大于分子晶体的熔点,故答案为:MgCl2为离子晶体而A1C13为分子晶体
(3)A的最高价含氧酸根离子是NO3-,NO3-中,中心N原子价层电子对=3+![]() =3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+
=3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+![]() =3,含有一个孤电子对,所以分子空间构型是V形,故答案为:sp2、V形
=3,含有一个孤电子对,所以分子空间构型是V形,故答案为:sp2、V形
(4)该晶胞中白色球个数=![]() =1,黑色小球个数=12×
=1,黑色小球个数=12×![]() =3,N元素形成的负价是-3价,所以该晶胞中含有3个亚铜离子1个N离子,所以其化学式为Cu3N;
=3,N元素形成的负价是-3价,所以该晶胞中含有3个亚铜离子1个N离子,所以其化学式为Cu3N;![]() =
=![]() =
=![]() 故答案为:Cu3N、
故答案为:Cu3N、![]()

【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):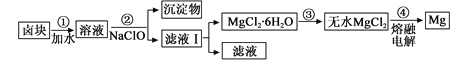
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。