��Ŀ����
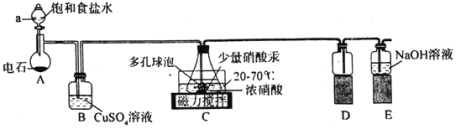
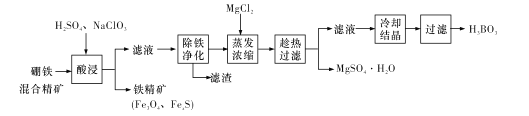
����Ŀ��������������ȫ�����ƹ㣬������Դ���ǿɳ�������ɫ��չ����Ҫ;�����ɽ�������(��Ҫ������ͭ�����ǵ�������)�Ƶü�ʽ̼��ͭ��Ħ����[(NH4)2SO4��FeSO4��xH2O]�Ĺ���������ͼ��ʾ��

��֪��Ksp[Fe(OH)3]=1��10-38��Ksp[Cu(OH)2]=2.2��10-20��һ����Ϊij����Ũ��С�ڻ����10-5mol/Lʱ��������ת����ȥ����ȫ��
��ش��������⣺
(1)�ȴ����������__��H2O2�ĵ���ʽΪ__��
(2)��pH�����ѡ�õ��Լ�Ϊ__��
A��CuO B��Cu(OH)2 C��Fe2O3 D��Fe(OH)3
(3)��������Һ��c(Cu2+)=0.22mol��L-1������Ҫ���ڵ�pH��Χ��__��
(4)��Һ1�������ȡ�������__ʱ����Ȼ��ȴ���ɵõ����壬Ȼ����ˣ��þƾ�ϴ�Ӿ��壬�ƾ�ϴ�ӵ�Ŀ����__��
(5)д�������������ɼ�ʽ̼��ͭ�����ӷ���ʽ__��
(6)ȡ3.92gĦ���β�Ʒ���ڸ��������������¼�����135��Cʱ��ȫʧȥ�ᾧˮ����ʱ��������Ϊ2.84g�����Ħ���νᾧˮ����x=__��
���𰸡�ȥ�����ϱ�������� ![]() AB 3~4.5 ��Һ������־�Ĥ(����Һ�г��־���) ��ȥ�������ˮ�� 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3-(��2Cu2++2CO32-+H2O=Cu2(OH)2CO3��+CO2��) 6
AB 3~4.5 ��Һ������־�Ĥ(����Һ�г��־���) ��ȥ�������ˮ�� 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3-(��2Cu2++2CO32-+H2O=Cu2(OH)2CO3��+CO2��) 6
��������
�����ȵĴ���Һ����������(��Ҫ������ͭ�����ǵ�������)�е���Ҫ�ɷֶ���������Ӧ�������ȵĴ���Һ������ֻ����ȥ�����ۣ�����H2SO4��H2O2�������������ܽⲢת��ΪFe3+��ͭ���������ܽ�����Cu2+����pH��Fe3+ת��ΪFe(OH)3�������������ܽ��������������ټ��뻹ԭ����ת��Ϊ�����������������������Ħ���Ρ���Һ�к���Cu2+������Na2CO3��Һ����˫ˮ�ⷴӦ����Cu2(OH)2CO3��
(1)�����Ϸ�����֪�������ȵĴ�����Һˮ��ʹ��Һ�ʽ�ǿ�ļ��ԣ��Ӷ��ﵽȥ�����۵�Ŀ�ģ���������ȥ�����ϱ�������ۣ�H2O2Ϊ���ۻ��ϼۣ��ȴ���O-H���ۼ����ִ���O-O���ۼ��������ʽΪ![]() ����Ϊ��ȥ�����ϱ�������ۣ�
����Ϊ��ȥ�����ϱ�������ۣ�![]() ��
��
(2)��pH��Ŀ�ģ��ǽ�Fe3+ת��ΪFe(OH)3������ͬʱ�������µ����ʣ���ѡ��CuO��Cu(OH)2�����Կ�ѡ�õ��Լ�ΪAB����Ϊ��AB��
(3) Ksp[Fe(OH)3]=1��10-38��c(Fe3+)=10-5mol/L��c(OH-)=10-11mol/L��pH=3����������Һ��c(Cu2+)=0.22mol��L-1������Ksp[Cu(OH)2]=2.2��10-20�������c(OH-)=![]() =
=![]() mol/L��pH=-lg(
mol/L��pH=-lg(![]() ��10-5)=4.5������Ҫ���ڵ�pH��Χ��3~4.5����Ϊ��3~4.5��
��10-5)=4.5������Ҫ���ڵ�pH��Χ��3~4.5����Ϊ��3~4.5��
(4)����Һ1�л��Ħ���ξ��壬�辭�����ȡ���������Һ������־�Ĥ(����Һ�г��־���)ʱ����Ȼ��ȴ���ɵõ����壬Ȼ����ˣ�Ϊ�����ʱ����ʧȥ�ᾧˮ�����Բ��ܲ��ú�ɵķ�������Ӧ�þƾ�ϴ�Ӿ��壬�ƾ�ϴ�ӵ�Ŀ���dz�ȥ�������ˮ�֡���Ϊ����Һ������־�Ĥ(����Һ�г��־���)����ȥ�������ˮ�֣�
(5)��������Cu2+������Na2CO3��Һ�����ò������ӷ���˫ˮ�ⷴӦ����Cu2(OH)2CO3�����ӷ���ʽΪ2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3-(��2Cu2++2CO32-+H2O=Cu2(OH)2CO3��+CO2��)����Ϊ��2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3-(��2Cu2++2CO32-+H2O=Cu2(OH)2CO3��+CO2��)��
(6)m[(NH4)2SO4��FeSO4]= 2.84g��n[(NH4)2SO4��FeSO4]=![]() =0.01mol��m(H2O)= 3.92g-2.84g=1.08g��n(H2O)=
=0.01mol��m(H2O)= 3.92g-2.84g=1.08g��n(H2O)=![]() =0.06mol�����Ħ���νᾧˮ����x=
=0.06mol�����Ħ���νᾧˮ����x=![]() =6����Ϊ��6��
=6������6��

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�����Ŀ��ijʵ��С���������ữ�ĸ��������Һ�������Һ��Ӧ�ⶨ��λʱ��������CO2������̽��Ӱ�췴Ӧ���ʵ����ء����ʵ�鷽�������
ʵ����� | A��Һ | B��Һ |
�� | 20mL0.1mol��L-1H2C2O4��Һ | 30mL0.02mol��L-1����KMnO4��Һ |
�� | 20mL0.2mol��L-1H2C2O4��Һ | 30mL0.02mol��L-1����KMnO4��Һ |
��1��ͼ1װ����ʢ��A��Һ������������_____��������ͼ1װ�������Եķ���Ϊ_____��

��2�������ữ�ĸ��������Һ�������Һ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ_____��
��3����ʵ��̽������_____���ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ʵ�����40sĩ�ռ���22.4mLCO2(��״����)������40s�ڣ�v(MnO4-)=_____(������Һ���ǰ������ı仯)��
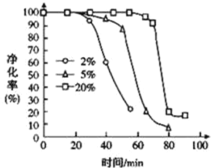
��4��С��ͬѧ��ͼ1�������ռ�װ�ø�Ϊͼ2��ʵ�������ȴ����ʱ����������Һ����ڸ����Һ�棬Ϊ�õ�ȷ���ݣ���ȡ�IJ����ǣ�____��
��5������ͨ���ⶨ��λʱ��������CO2��������ȽϷ�Ӧ���ʣ���ʵ�黹����ͨ���ⶨ____���Ƚϻ�ѧ��Ӧ���ʡ�
��6��ͬѧ����ʵ���з��ַ�Ӧ����������ͼ3��ʾ��̽��t1��t2ʱ�������ʱ�����Ҫԭ������ǣ�____��
A.�÷�Ӧ���� B.���ɵ�Mn2+������� C.K2SO4Ũ������