题目内容
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法不正确的是( )
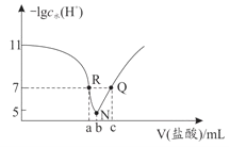
A.常温下,Kb(NH3·H2O)约为1×10-5
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积不相等
【答案】C
【解析】
还没滴HCl时,溶质为:NH3·H2O,抑制水的电离,c水(H+)﹤10-7,-1gc水(H+)>7;NH3·H2O和HCl反应生成NH4Cl和H2O,二者恰好完全反应时溶质为:NH4Cl,促进水的电离,水的电离程度最大,对应N点;所以R点溶质为:NH4Cl和NH3·H2O,Q点溶质为:NH4Cl和HCl,据此分析解答。
A.V(HCl)=0时,溶质为NH3·H2O,此时溶液中的H+全都是由水电离的,所以-1gc(H+)=-1gc水(H+)=11,即c(H+)=10-11,c(OH-)=![]() =10-3mol/L,所以Kb(NH3·H2O) =
=10-3mol/L,所以Kb(NH3·H2O) =![]() =
=![]() ,A正确;
,A正确;
B.b=20mL时,HCl的物质的量= NH3·H2O的物质的量,NH3·H2O和HCl恰好完全反应,溶质为NH4Cl,促进水的电离,水的电离程度最大,-1gc水(H+)最小,B正确;
C.R点溶质为:NH4Cl和NH3·H2O,水的电离程度不促进也不抑制,说明该点NH4Cl的水解程度和NH3·H2O的电离程度相等,显中性,Q点溶质为:NH4Cl和HCl,一定显酸性,C错误;
D.R到N,一方面滴加HCl消耗了NH3·H2O的抑制作用,另一方面生成的NH4Cl还直接起到促进水的电离的作用,N到Q,仅仅HCl起到抑制作用,但是R点和Q点水的电离程度是相等的,那么必然有R到N的HCl的体积小于N到Q所加盐酸体积,D正确。
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大