题目内容
12.常温下,浓度均为0.1mol•L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )| A. | 氨水中,c(NH4+)=c(OH-)=0.1 mol•L-1 | |
| B. | NH4Cl溶液中,c(NH4+)>c(Cl-) | |
| C. | Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
分析 A.氨水为弱碱,一水合氨在溶液中部分电离出氢氧根离子,结合电荷守恒分析;
B.铵根离子部分水解,导致溶液中铵根离子浓度减小;
C.硫酸钠溶液为中性溶液,则c(OH-)=c(H+),结合电荷守恒可得c(Na+)=2c(SO42-);
D.根据亚硫酸钠溶液中的物料守恒判断.
解答 解:A.氨水为弱碱,溶液中只能部分电离出氢氧根离子,结合电荷守恒c(NH4+)+c(H+)=c(OH-)可得:c(NH4+)<c(OH-)<0.1 mol•L-1,故A错误;
B.NH4Cl溶液中,铵根离子部分水解、氯离子浓度不变,则溶液中c(NH4+)<c(Cl-),故B错误;
C.Na2SO4溶液显示,则c(OH-)=c(H+),结合电荷守恒可得:c(Na+)=2c(SO42-),溶液溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(OH-)=c(H+),故C正确;
D.根据亚硫酸钠溶液中的物料守恒可得:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中应用,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
17.化学与生活、社会密切相关.下列有关说法正确的是( )
| A. | 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖 | |
| B. | 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |
4.如图图示与对应的叙述不相符的是( )


| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
5.用下列有关实验装置进行相应实验,能达到实验目的是( )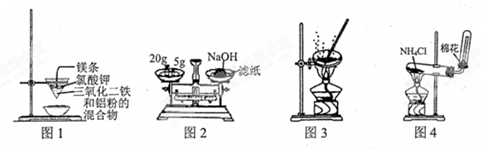

| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
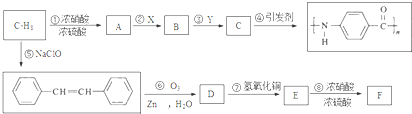
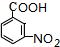 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有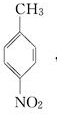 和
和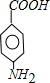 .(填结构简式)
.(填结构简式)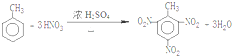 .
.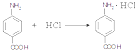 .
.