题目内容
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
分析 从B4C的用途推算其物理性质,进而可确定晶体类型为原子晶体,原子晶体的组成微粒是原子,不含分子,B4C中C和B形成四对共用电子.
解答 解:A.新型材料B4C可用于制作切削工具和高温热交换器,表现了B4C具有硬度大、熔点高的特性,而分子晶体硬度小、熔沸点低,故A错误;B.B4C属于原子晶体,组成微粒是C、B原子,不含分子,故B错误;
C.新型材料B4C可用于制作切削工具和高温热交换器,表现了B4C具有硬度大、熔点高的特性,说明其属于原子晶体,故C正确;
D.原子晶体中原子间以共价键相结合,B4C中C和B形成四对共用电子,电子式为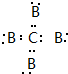 ,故D错误;
,故D错误;
故选C.
点评 本题考查晶体类型的判断,题目难度不大,注意物质组成元素以及晶体类型与性质之间的关系.

练习册系列答案
相关题目
12.下列有关说法中错误的是( )
| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
13.某pH=1的X溶液中可能含有Fe2+、Al3+,NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )
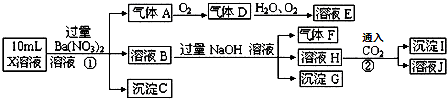

| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
10.用NA表示阿伏伽德罗常数的值,下列叙述正确的是(Cu-64 O-32)( )
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
17.化学与社会、生产、生活紧密相关,下列说法正确的是( )
| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
7.将下列物质分别加入溴水中,不能使溴水褪色的是( )
| A. | Na2SO3晶体 | B. | 乙醇 | C. | C6H6 | D. | Fe |
12.常温下,浓度均为0.1mol•L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
| A. | 氨水中,c(NH4+)=c(OH-)=0.1 mol•L-1 | |
| B. | NH4Cl溶液中,c(NH4+)>c(Cl-) | |
| C. | Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
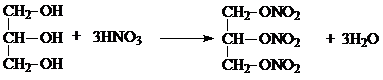 .
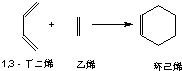
.
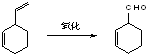
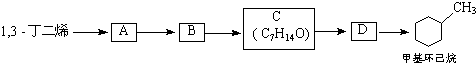
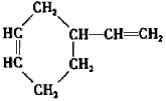 ;B
;B