题目内容
4.如图图示与对应的叙述不相符的是( )
| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
分析 A.能形成压强差的装置能检验装置气密性;
B.溴与氢氧化钠反应导致上层液体颜色变浅;
C.此为水果电池,是铜锌原电池,锌活泼为负极,铜为正极;
D.图中反应物的总能量高于生成物的总能量,应为放热反应,且是氢气与氧气反应生成水.
解答 解:A.该装置中乙中两管液体能形成压强差,可以根据左边管中液体高度是否变化检验装置气密性,故A正确;
B.溴能与碱性溶液氢氧化钠反应生成溴化钠和次溴酸钠,故上层苯中溶解的溴浓度减小,颜色变浅,故B正确;
C.此为水果电池,是铜锌原电池,锌活泼为负极,铜为正极,故有电流产生,故C错误;
D.图中反应物的总能量高于生成物的总能量,应为放热反应,且是氢气与氧气反应生成水,若为液体水分解,热化学反应方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol,故D正确,
故选C.
点评 本题主要考查的是气密性检查、原电池工作原理、反应热的计算等,难度不大,综合性较强,注意总结归纳.

练习册系列答案
相关题目
12.常温下,浓度均为0.1mol•L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
| A. | 氨水中,c(NH4+)=c(OH-)=0.1 mol•L-1 | |
| B. | NH4Cl溶液中,c(NH4+)>c(Cl-) | |
| C. | Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
9.关于羟基的说法正确的是( )
| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
16.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3+Cu→2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液及其形成的判断正确的是( )
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
17.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
①向等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-.
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
18.下列说法正确的是( )
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
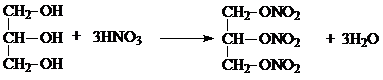 .
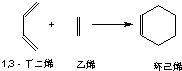
.
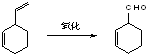
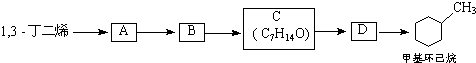
 ;B
;B