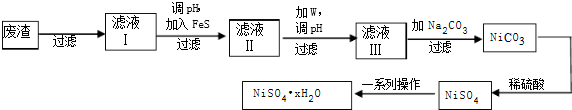
题目内容
3.已知:(Ⅰ)当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子.使新取代基进入它的邻、对位的取代基有-CH3、-NH2等;使新取代基进入它的间位的取代基有-COOH、-NO2等;(Ⅱ)R-CH=CH-R′$\stackrel{O_{3},Zn/H_{2}O}{→}$R-CHO+R′-CHO
(Ⅲ)氨基(-NH2)易被氧化;硝基(-NO2)可被Fe和盐酸还原成氨基(-NH2),如图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图.
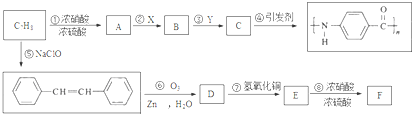
回答下列问题:
(1)写出反应类型.反应①取代反应,反应④缩聚反应.
(2)X、Y是下列试剂中的一种,其中X是b,Y是a.(填序号)
a.Fe和盐酸 b.酸性KMnO4溶液 c.NaOH溶液
(3)已知B和F互为同分异构体,写出F的结构简式
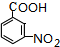 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有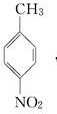 和
和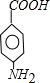 .(填结构简式)
.(填结构简式)(4)反应①在温度较高时,还可能发生的化学方程式
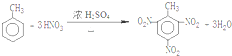 .
.(5)写出C与盐酸反应的化学方程式
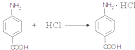 .
.
分析 C7H8为 ,在浓硫酸作催化剂、加热条件下,
,在浓硫酸作催化剂、加热条件下, 和浓硝酸发生取代反应生成A,A和X反应生成B,B和Y反应生成C,C发生反应生成某聚酰胺类物质(C7H5NO)n,根据某聚酰胺类物质(C7H5NO)n的结构简式知,反应④发生缩聚反应,则C的结构简式为:
和浓硝酸发生取代反应生成A,A和X反应生成B,B和Y反应生成C,C发生反应生成某聚酰胺类物质(C7H5NO)n,根据某聚酰胺类物质(C7H5NO)n的结构简式知,反应④发生缩聚反应,则C的结构简式为: ,根据
,根据 和C的结构简式知,
和C的结构简式知, 和硝酸发生对位取代,生成
和硝酸发生对位取代,生成 ,则A是
,则A是 ,氨基易被氧化,所以A先发生氧化反应生成
,氨基易被氧化,所以A先发生氧化反应生成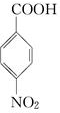 ,所以B是
,所以B是 ,对硝基苯甲酸被还原生成C,对氨基苯甲酸;根据信息(Ⅱ),则反应⑥生成的D为
,对硝基苯甲酸被还原生成C,对氨基苯甲酸;根据信息(Ⅱ),则反应⑥生成的D为 ,与新制氢氧化铜反应生成E为
,与新制氢氧化铜反应生成E为 ,E与浓硝酸和浓硫酸间位取代生成F为
,E与浓硝酸和浓硫酸间位取代生成F为 ,据此分析解答
,据此分析解答
解答 解:C7H8为 ,在浓硫酸作催化剂、加热条件下,
,在浓硫酸作催化剂、加热条件下, 和浓硝酸发生取代反应生成A,A和X反应生成B,B和Y反应生成C,C发生反应生成某聚酰胺类物质(C7H5NO)n,根据某聚酰胺类物质(C7H5NO)n的结构简式知,反应④发生缩聚反应,则C的结构简式为:
和浓硝酸发生取代反应生成A,A和X反应生成B,B和Y反应生成C,C发生反应生成某聚酰胺类物质(C7H5NO)n,根据某聚酰胺类物质(C7H5NO)n的结构简式知,反应④发生缩聚反应,则C的结构简式为: ,根据
,根据 和C的结构简式知,
和C的结构简式知, 和硝酸发生对位取代,生成
和硝酸发生对位取代,生成 ,则A是
,则A是 ,氨基易被氧化,所以A先发生氧化反应生成
,氨基易被氧化,所以A先发生氧化反应生成 ,所以B是
,所以B是 ,对硝基苯甲酸被还原生成C,对氨基苯甲酸;根据信息(Ⅱ),则反应⑥生成的D为
,对硝基苯甲酸被还原生成C,对氨基苯甲酸;根据信息(Ⅱ),则反应⑥生成的D为 ,与新制氢氧化铜反应生成E为
,与新制氢氧化铜反应生成E为 ,E与浓硝酸和浓硫酸间位取代生成F为
,E与浓硝酸和浓硫酸间位取代生成F为 ,
,
(1)根据上面的分析可知,反应①为取代反应,反应④为缩聚反应,
故答案为:取代反应;缩聚反应;
(2)X是将 氧化成
氧化成 ,所以X是酸性KMnO4溶液,Y是将B
,所以X是酸性KMnO4溶液,Y是将B 还原成C
还原成C ,所以Y是Fe和盐酸,
,所以Y是Fe和盐酸,
故选:b;a;
(3)根据上面的分析可知,F的结构简式 ,A~E中互为同分异构体的还有
,A~E中互为同分异构体的还有 和
和 ,
,
故答案为: ;
; 和
和 ;
;
已知B和F互为同分异构体,写出F的结构简式.A~E中互为同分异构体的还有 和.(填结构简式)
(4)反应①在温度较高时,还可能发生三硝基取代,反应的化学方程式为 ,
,
故答案为: ;
;
(5)C的结构简式为: ,C与盐酸反应的化学方程式为
,C与盐酸反应的化学方程式为 ,
,
故答案为: .
.
点评 本题主要考查了有机性质和有机推断,中等难度,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力;该题的关键是明确各种官能团结构和性质,然后结合信息进行推断,有助于培养学生的创新思维能力和应试能力.

| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |

| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
| A. | 氨水中,c(NH4+)=c(OH-)=0.1 mol•L-1 | |
| B. | NH4Cl溶液中,c(NH4+)>c(Cl-) | |
| C. | Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
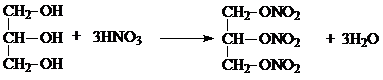 .
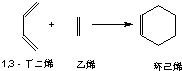
.
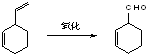
 ;B
;B