题目内容
5.用下列有关实验装置进行相应实验,能达到实验目的是( )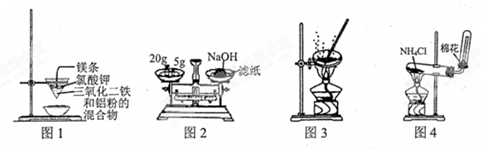
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
分析 A.铝能与三氧化二铁反应得到铁;
B.左物右码;
C.CuCl2在加热时水解生成氢氧化铜;
D.氯化氢与氨气遇冷又生成氯化铵.
解答 解:A.镁燃烧提供的高温可引发反应,铝能与三氧化二铁反应得到铁,故A正确;
B.称量时左物右码,故B错误;
C.CuCl2在加热时水解生成氢氧化铜,不能直接用蒸发的方法制备,故C错误;
D.加热氯化铵生成氨气与氯化氢,氯化氢与氨气遇冷又生成氯化铵,无法获得氨气,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、称量等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
12.常温下,浓度均为0.1mol•L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
| A. | 氨水中,c(NH4+)=c(OH-)=0.1 mol•L-1 | |
| B. | NH4Cl溶液中,c(NH4+)>c(Cl-) | |
| C. | Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
9.关于羟基的说法正确的是( )
| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
16.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3+Cu→2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液及其形成的判断正确的是( )
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
10.下列说法正确的是( )
| A. | 配制1.001.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| B. | 在50mL量筒中配制0.100 0moL•L-1碳酸钠溶液 | |
| C. | 只有100mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100mLpH=2的盐酸 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
17.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
①向等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-.
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
15.下列关于化学反应速率的说法中正确的是( )
| A. | 化学反应速率可用某时刻生成物的物质的量来表示 | |
| B. | 在同一反应中,用反应物或生成物表示的化学反应速率的值是相对的 | |
| C. | 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 | |
| D. | 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |