题目内容
14.下列说法中正确的是( )| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
分析 A、同周期自左而右,元素的第一电离能增大,注意能级处于半满、全满的稳定特殊情况;
B、同周期从左到右非金属性增强,电负性增强;
C、同周期元素第一电离能从左到右有增大的趋势,所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素,同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,第一电离能由大变小,元素的金属性逐渐增强;
D、第四周期中砷的外围电子排布为:4s24p3半满稳定.
解答 解:A、同周期自左而右,元素的第一电离能增大,注意能级处于半满、全满的稳定特殊情况,所以第三周期所含元素中Ar的第一电离能最大,故A错误;
B、同周期从左到右非金属性增强,电负性增强,所以磷的电负性比硫的电负性小,故B错误;
C、同周期元素第一电离能从左到右有增大的趋势,所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素,同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,第一电离能由大变小,元素的金属性逐渐增强,所以自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小,故C正确;
D、第四周期中砷的外围电子排布为:4s24p3半满稳定,所以元素砷的第一电离能比元素硒的第一电离能大,故D错误;
故选C.
点评 本题考查了第一电离能和电负性的大小比较,把握同周期元素的第一电离能变化规律即可解答,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.下列说法正确的是( )
| A. | 阴、阳离子间通过静电引力而形成的化学键称为离子键 | |
| B. | 在MgO和CO2 晶体中都不存在单个分子 | |
| C. | 金属中存在自由移动的带电微粒,所以能导电 | |
| D. | 离子晶体中存在带电微粒,所以能导电 |
5.下列关于ⅡA族元素的说法中,不正确的是( )
| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
2.下列关于物质分类的说法正确的是( )
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
6.电子构型为[Ar]3d54s2的元素是( )
| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
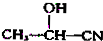 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$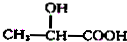
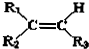 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$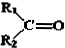 +
+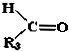
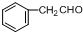 .现有如下转化关系:
.现有如下转化关系: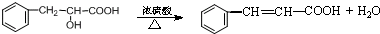 ;反应类型为消去反应;
;反应类型为消去反应;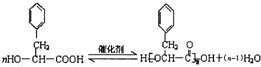 ;
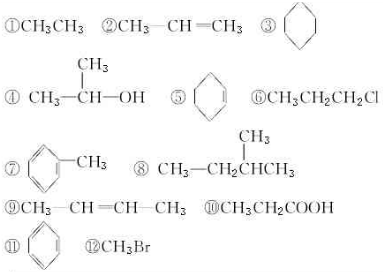
;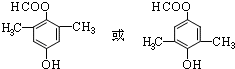 .
.
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$
 .
. ;该反应类型酯化反应
;该反应类型酯化反应