题目内容
6.电子构型为[Ar]3d54s2的元素是( )| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
分析 元素的能层数等于其周期数,从第ⅢB族到第ⅥB族,其外围电子数等于其族序数,而第ⅠB族、第ⅡB族,其最外层电子数等于其族序数,据此分析解答.
解答 解:元素外围电子构型为3d54s2,根据电子排布式知,该原子含有4个能层,所以位于第四周期,外围电子总数为7,即处于ⅦB族,故该元素位于第四周期第ⅦB族,是过渡元素,故选:A.
点评 本题考查了结构与位置关系,根据能层与周期、价电子与族的关系即可解答,难度中等.

练习册系列答案
相关题目
17.在某条件下,Zn与稀硝酸反应时,其物质的量之比为2:5,则此时硝酸的还原产物是( )
| A. | NO2 | B. | NO | C. | N2 | D. | NH4NO3 |
14.下列说法中正确的是( )
| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
1.某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Fe,负极为Zn,电解质Fe2(SO4)3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质FeCl3溶液 | |
| C. | 正极为Cu,负极为Fe,电解质Fe(NO3)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质Fe2(SO4)3溶液 |
11.(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1所示.
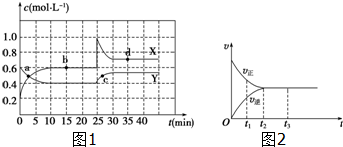
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
根据以上数据回答问题:
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.

①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
15.对某一可逆反应来说,使用催化剂的作用( )
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
 .
.