题目内容
5.下列关于ⅡA族元素的说法中,不正确的是( )| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
分析 A.主族元素最高正化合价等于其族序数(O、F元素除外);
B.ⅡA族元素单质都呈银白色金属;
C.ⅡA族元素均为金属元素,性质活泼,在自然界中没有游离态的单质;
D.Mg元素被誉为“国防金属”的元素.
解答 解:A.主族元素最高正化合价等于其族序数(O、F元素除外),ⅡA族元素的主要化合价都是+2价,故A正确;
B.ⅡA族元素单质都呈银白色金属,故B正确;
C.ⅡA族元素均为金属元素,性质活泼,在自然界中没有游离态的单质,故C错误;
D.ⅡA族中Mg元素被誉为“国防金属”的元素,故D正确,
故选C.
点评 本题考查同一主族元素元素性质递变性与相似性,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
4.某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
①该小组在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响.
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
①写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
20.为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色Ag.(夹持及加热仪器均省略)
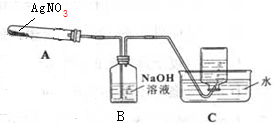
(1)如何检验装置的气密性?连接好仪器后在未加药品之前加热试管,如果C中导气管有气泡冒出,说明气密性良好.
(2)C中集气瓶收集的气体为O2.要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)甲同学认为仅凭试管A中的红棕色的气体产生就判定NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排尽装置中的空气.你是否同甲的观点?并说明理由否,硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe3+.
假设二:Fe被氧化成Fe2+.
假设三:Fe被氧化成Fe3+或Fe2+.
可选用的试剂:KSCN溶液、酸性KMnO4溶液,氨水,盐酸,硝酸,NaCl溶液
请完成下表:
实验结论:Fe的氧化物为Fe2+和Fe3+.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色Ag.(夹持及加热仪器均省略)

(1)如何检验装置的气密性?连接好仪器后在未加药品之前加热试管,如果C中导气管有气泡冒出,说明气密性良好.
(2)C中集气瓶收集的气体为O2.要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)甲同学认为仅凭试管A中的红棕色的气体产生就判定NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排尽装置中的空气.你是否同甲的观点?并说明理由否,硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe3+.
假设二:Fe被氧化成Fe2+.
假设三:Fe被氧化成Fe3+或Fe2+.
可选用的试剂:KSCN溶液、酸性KMnO4溶液,氨水,盐酸,硝酸,NaCl溶液
请完成下表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |
10.下列关于元素周期表的叙述,正确的是( )
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
17.在某条件下,Zn与稀硝酸反应时,其物质的量之比为2:5,则此时硝酸的还原产物是( )
| A. | NO2 | B. | NO | C. | N2 | D. | NH4NO3 |
14.下列说法中正确的是( )
| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
15.对某一可逆反应来说,使用催化剂的作用( )
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |