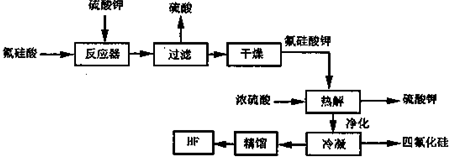
题目内容
2.下列关于物质分类的说法正确的是( )| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
分析 A.不同分散系化分的依据为:分散质粒度大小;
B.电解质和非电解质都是化合物;
C.含有碳元素的物质不一定是有机物;
D.重金属一般指密度大于4.5克每立方厘米的金属,密度小于4.5克/立方匣米,属于轻金属.
解答 解:A.分散系按照分散质粒度大小不同可以划分为溶液、胶体、浊液,故A错误;
B.根据在水溶液里或熔化状态下是否导电把化合物分为电解质、非电解质,故B错误;
C.含有碳元素的物质不一定是有机物,例如二氧化碳、一氧化碳、碳酸、碳酸盐,都含有碳,但是属于无机化合物,故C错误;
D.重金属一般指密度大于4.5克每立方厘米的金属,密度小于4.5克/立方匣米,属于轻金属,该分类依据为:金属的密度大小,故D正确;
故选:D.
点评 本题考查了常见化学概念,熟悉电解质、非电解质、有机化合物的概念是解题关键,注意分散系、金属的分类依据,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
1.甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,有关说法正确的是( )
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
10.下列关于元素周期表的叙述,正确的是( )
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
17.在某条件下,Zn与稀硝酸反应时,其物质的量之比为2:5,则此时硝酸的还原产物是( )
| A. | NO2 | B. | NO | C. | N2 | D. | NH4NO3 |
14.下列说法中正确的是( )
| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
11.(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1所示.
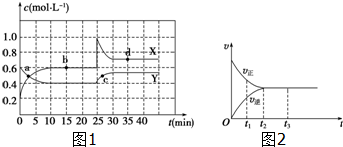
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
根据以上数据回答问题:
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.

①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
12.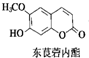 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )| A. | 分子式为C10H12O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 一定条件下,1 mol该物质最多可与3 mol Br2反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |