题目内容
3.H2O2、NH3都是用途广泛的工业产品.I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
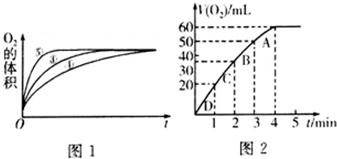
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.
分析 I.(1)为了便于比较,应在相同的条件下利用一个变量来比较,实验①和②的浓度不同;
(2)由图可知,⑤的反应速率最大,④的反应速率最小;
(3)由图可知,相同时间内生成氧气越来越少,则反应速率越来越慢,与浓度有关;结合2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑及c=$\frac{n}{V}$计算;
II(1)①N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ•mol-1
②2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ•mol-1
结合盖斯定律可知②×3+①×2得到:2N2 (g)+6H2O (1)=4NH3(g)+3O2(g),以此计算△H;
(2)①负极是氨气失电子生成氮气;
②阳极反应式为2H2O-4e-=4H++O2↑,阴极反应式为Cu2++2e-=Cu,总的反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+2H2SO4.
解答 解:I.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,故答案为:探究浓度对反应速率的影响;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知均存在催化剂,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率;
(3)由图可知,相同时间内生成氧气越来越少,则反应速率越来越慢,可知反应速率变化的原因是H2O2溶液的浓度逐渐减小;n(O2)=$\frac{0.06L}{22.4L/mol}$=0.0027mol,则c(H2O2)=$\frac{n}{V}$=$\frac{0.0027mol×2}{0.05L}$≈0.11mol/L,故答案为:H2O2溶液的浓度逐渐减小;0.11mol/L;
II.(1)①N2 (g)+3H2 (g)═2NH3 (g)△H=-a kJ•mol-1
②2H2O(1)═2H2 (g)+O2 (g)△H=+b kJ•mol-1
由盖斯定律可知②×3+①×2得到:2N2 (g)+6H2O (1)=4NH3(g)+3O2(g)△H=-(2a-3b) kJ•mol-1 ;
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ•mol-1 ;
故答案为:4NH3(g)+3O2(g)=2N2 (g)+6H2O (1)△H=(2a-3b) kJ•mol-1 ;
(2)①电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O;
①用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+,故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.
点评 本题考查较综合,涉及反应速率的影响因素、电解原理及应用、盖斯定律计算反应热等,综合性较强,注重高频考点的考查,把握反应原理为解答的关键,题目难度中等.

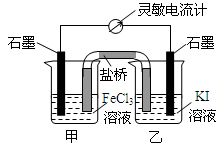
| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
| A. | 柴油、汽油、牛油、植物油等属于烃类物质 | |
| B. | 含五个碳原子的有机物,分子中最多可形成四个碳碳单键 | |
| C. | 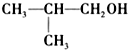 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 | |
| D. | 结构片段为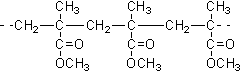 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
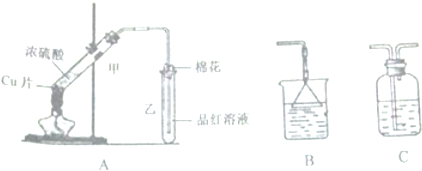
| A. | 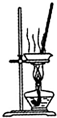 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 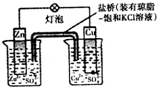 装置盐桥中的K+自右向左移动 | |
| C. | 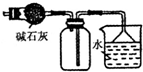 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. | 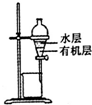 装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
H2CrO4═HCrO${\;}_{4}^{-}$+H+
HCrO${\;}_{4}^{-}$?CrO${\;}_{4}^{2-}$+H+ Ka=3.2×10-7mol.L-1
下列判断正确的是( )
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入几滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$变大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等浓度的:NaHCrO4溶液与NaHCO3溶液中,水的电离程度前者大 |
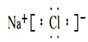 .
.