题目内容
18.探究铜与浓硫酸反应的装置如图所示.试验中观察到:A中有白雾产生,铜片表面变黑并附着有细小黑色颗粒物;B中有白色沉淀物生成.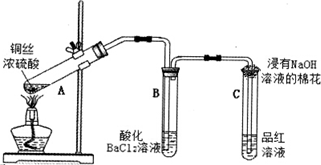
请回答下列问
(1)证明有SO2生成的现象是品红溶液褪色.
(2)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(3)反应结束后,为检验A中有CuSO4生成,实验操作是:熄灭酒精灯并使A中溶液冷却到室温,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色.
(4)关于试管B中有白色沉淀生成的解释,不合理的是C.
A.硫酸分解生成了SO3 B.硫酸在温度高时挥发 C.SO2与氯化钡溶液反应生成BaSO3
(5)为证明附着在铜片上的黑色物质含有硫元素,将洗涤后含黑色物质的铜片,用足量浓硝酸溶解后,还应选用的试剂是BaCl2溶液(填化学式).
(6)若反应结束时3.2g铜丝完全溶解,用中和滴定法测定剩余硫酸的物质的量.将A中残余液稀释至1000mL,所需要的仪器有烧杯、玻璃棒、1000mL容量瓶、胶头滴管;若以NaOH溶液为试剂,以酚酞为指示剂,将使测定结果偏高(“偏高”、“偏低”、“无影响”).(已知:酚酞变色范围pH=8.0~10.0,Ksp[Cu(OH)2]=5.0×10-20)
分析 (1)二氧化硫具有漂白性,能使品红褪色;
(2)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水;
(3)硫酸铜溶于水溶液显蓝色;
(4)酸性条件下,SO2与氯化钡溶液不反应;
(5)黑色物质含有硫元素,加硝酸溶解会生成硫酸根,根据检验硫酸根的方法分析;
(6)根据溶液配制的操作分析;3.2g铜丝完全溶解,溶液中铜离子的物质的量为0.05mol,配成1L溶液,则铜离子浓度为0.05mol/L,根据Ksp[Cu(OH)2]计算生成沉淀时溶液中氢氧根离子的浓度,根据酚酞变色范围pH=8.0~10.0判断是否有氢氧化铜沉淀,再分析测定结果的误差.
解答 解:(1)二氧化硫具有漂白性,能使品红褪色,当C中品红溶液褪色,说明反应中生成二氧化硫,故答案为:品红溶液褪色;
(2)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水,其反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使A中溶液冷却到室温,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
故答案为:将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
(4)酸性条件下,SO2与氯化钡溶液不反应,所以B中出现变白色沉淀不可能是SO2与氯化钡溶液反应生成BaSO3;
故答案为:C;
(5)黑色物质含有硫元素,加硝酸溶解会生成硫酸根,检验硫酸根的试剂一般用BaCl2溶液;
故答案为:BaCl2溶液;
(6)配制1000mL溶液需要烧杯、玻璃棒、1000mL容量瓶、胶头滴管;3.2g铜丝完全溶解,溶液中铜离子的物质的量为0.05mol,配成1L溶液,则铜离子浓度为0.05mol/L,Ksp[Cu(OH)2]=c(Cu2+)×c2(OH-),c(OH-)=$\sqrt{\frac{5.0×1{0}^{-20}}{0.05}}$=10-9mol/L,则pH=9时会有氢氧化铜沉淀生成,已知酚酞变色范围pH=8.0~10.0,所以在滴定终点时会有氢氧化铜沉淀生成,则滴定时消耗的氢氧化钠的体积偏大,所以测得结果偏高;
故答案为:1000mL容量瓶、胶头滴管;偏高.
点评 本题综合考查性实验设计、物质组成的探究实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握相关物质的性质以及实验原理.

 阅读快车系列答案
阅读快车系列答案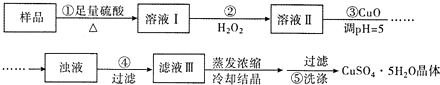
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
Ⅰ.用Ⅰ1、Ⅰ2、Ⅰ3、Ⅰ4表示钪的电离能,其数据如图1.
(1)与钪同周期且含有相同未成对电子数的非金属元素为Br(填元素符号).
(2)$\frac{{I}_{2}}{{I}_{1}}$<$\frac{{I}_{4}}{{I}_{3}}$(填“>”或“<”).
(3)氯化钠晶体熔点高于氯化钾,其原因为钠离子半径小于钾离子,氯化钠晶格能大于氯化钾,所以氯化钠熔点高.
Ⅱ.提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为2种.
(6)Sc2(C2O4)3•6H2O从583K加热到873K,断裂的化学键类型为离子键、共价键.
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
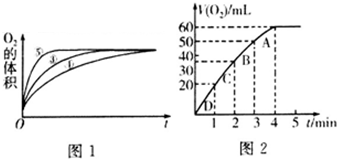
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
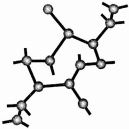 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2. 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.