题目内容
8.下列关于各实验装置的叙述中,正确的是( )| A. | 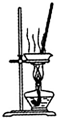 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 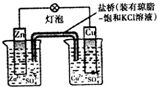 装置盐桥中的K+自右向左移动 | |
| C. | 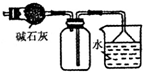 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. |  装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
分析 A.加热时应防止氯化铝水解;
B.原电池工作时,阳离子向正极移动;
C.HCl不能用碱石灰干燥;
D.四氯化碳不溶于水,且密度比水大.
解答 解:A.氯化铝水解生成氢氧化铝,加热时应防止氯化铝水解,否则不能得到氯化铝,故A错误;
B.锌比铜活泼,为原电池负极,铜为正极,原电池工作时,阳离子向正极移动,故B错误;
C.HCl不能用碱石灰干燥,故C错误;
D.四氯化碳不溶于水,且密度比水大,可用于分液的方法分离,四氯化碳在下层,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类的水解、原电池、气体额干燥以及分液等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.

练习册系列答案
相关题目
3.H2O2、NH3都是用途广泛的工业产品.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.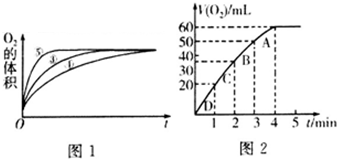
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.

20.某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )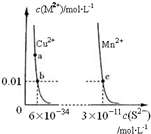

| A. | 该温度下,Ksp(CuS)小于Ksp(MnS) | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1 | |
| D. | a点对应的 Ksp大于b点对应的Ksp |
18.硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题:
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为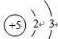 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
①写出硼砂溶液和稀硫酸反应的离子方程式5H2O+B4O72-+2H+=4H3BO3.
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.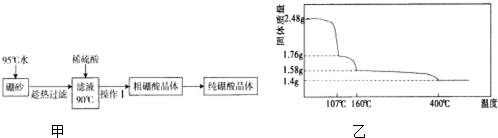
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为
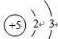 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.

 .
. .
. 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为: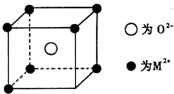 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA. .
.
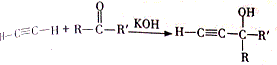
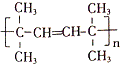 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.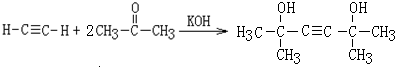 .
.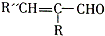 +H2O
+H2O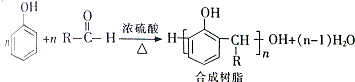
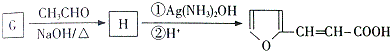
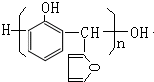 .
.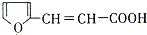 的所有同分异构体的结构简式
的所有同分异构体的结构简式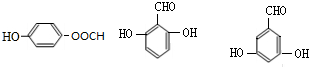 .
.