题目内容
13.下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题: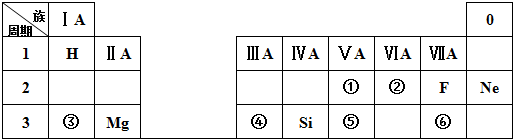
(1)⑤表示的元素是P(填元素符号);
(2)①、⑤两种元素相比较,原子半径较大的是P(填元素符号);
(3)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)写出③与⑥两种元素所形成化合物的电子式
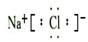 .
.
分析 由与元素在周期表中的位置可知①~⑥分别为N、O、Na、Al、P、Cl等,
(1)⑤位于第三周期第ⅤA族,是P元素;
(2)根据元素在周期表中的位置可以确定①⑤分别为N、P,同主族自上而下原子半径逐渐增大;
(3)③位于第三周期第ⅠA族,是Na元素,其最高价氧化物对应的水化物为NaOH,④位于第三周期第ⅢA族,是Al元素,其最高价氧化物对应的水化物为Al(OH)3,氢氧化铝具有两性,可与氢氧化钠反应生成偏铝酸钠;
(4)根据元素在周期表中的位置可以确定③⑥分别为Na、Cl,形成的化合物是离子化合物NaCl.
解答 解:由与元素在周期表中的位置可知①~⑥分别为N、O、Na、Al、P、Cl等,
(1)位于第三周期第ⅤA族,是P元素,故答案为:P;
(2)①位于第二周期第ⅤA族,是N元素,⑤位于第三周期第ⅤA族,是P元素,同主族自上而下原子半径逐渐增大,原子半径:P>N,因此原子半径较大的是P,
故答案为:P;
(3)③位于第三周期第ⅠA族,是Na元素,其最高价氧化物对应的水化物为NaOH,④位于第三周期第ⅢA族,是Al元素,其最高价氧化物对应的水化物为Al(OH)3,Al(OH)3与NaOH反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)③位于第三周期第ⅠA族,是Na元素,⑥位于第三周期第ⅦA族,是Cl元素,形成的化合物是离子化合物NaCl,电子式为: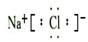
故答案为: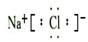 .
.
点评 本题考查元素周期表的结构和元素周期律综合应用,为高频考点,侧重于学生的分析能力的考查,通过元素在周期表中的位置确定是何种元素是解题的关键,试题比较基础,难度中等.

练习册系列答案
相关题目
3.H2O2、NH3都是用途广泛的工业产品.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.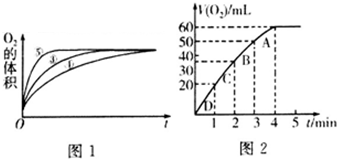
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.

8.可逆反应在一定条件下达到化学反应限度时( )
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
18.硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题:
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为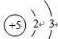 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
①写出硼砂溶液和稀硫酸反应的离子方程式5H2O+B4O72-+2H+=4H3BO3.
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.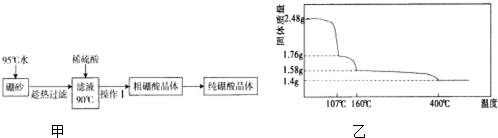
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为
 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.

2.全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
请回答:
①在一周的观察过程中,他发现实验序号为II的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 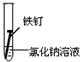 | 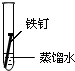 | 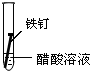 |
①在一周的观察过程中,他发现实验序号为II的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.

 ;
; 、和
、和 ;
; .
. .请回答:
.请回答: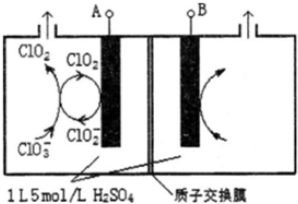 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义. 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广.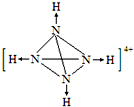 .
.